2 基本信息
《食管癌诊疗指南(2022年版)》由国家卫生健康委办公厅于2022年4月3日《国家卫生健康委办公厅关于印发肿瘤和血液病相关病种诊疗指南(2022年版)的通知》(国卫办医函〔2022〕104号)印发,要求各省、自治区、直辖市及新疆生产建设兵团卫生健康委组织做好实施工作。
3 发布通知
国家卫生健康委办公厅关于印发肿瘤和血液病相关病种诊疗指南(2022年版)的通知
国卫办医函〔2022〕104号
各省、自治区、直辖市及新疆生产建设兵团卫生健康委:
为进一步提高肿瘤和血液病诊疗规范化水平,保障医疗质量安全,维护患者健康权益,我委委托有关单位制修订了肿瘤和血液病相关病种诊疗指南。现印发给你们(见附件,可在国家卫生健康委网站医政医管栏目下载),请各地卫生健康行政部门组织做好实施工作。
附件:
2.膀胱癌诊疗指南(2022年版)
5.胰腺癌诊治指南(2022年版)
6.肾癌诊疗指南(2022年版)
7.乳腺癌诊疗指南(2022年版)
8.子宫内膜癌诊疗指南(2022年版)
12.甲状腺癌诊疗指南(2022版)
13.脑胶质瘤诊疗指南(2022年版)
16.弥漫性大B细胞淋巴瘤诊疗指南(2022年版)
17.骨髓增生异常综合征伴原始细胞增多(MDS-EB)诊疗指南(2022年版)
18.慢性髓性白血病诊疗指南(2022年版)
19.血友病A诊疗指南(2022年版)
20.慢性淋巴细胞白血病-小淋巴细胞淋巴瘤诊疗指南(2022年版)
国家卫生健康委办公厅
2022年4月3日
4 诊疗指南全文
4.1 一、概述
食管癌已是全球范围内常见的恶性肿瘤之一,据2020年全球癌症统计,食管癌的新发病人数达 60.4 万,死亡人数达54.4万。中国是食管癌高发地区,虽然中国食管癌的发病率及死亡率均呈下降趋势,但依旧是威胁我国居民健康的主要恶性肿瘤。根据2015年中国恶性肿瘤流行情况估计,我国食管癌新发病例24.6 万,我国食管癌粗发病率 17.8/10 万,城市粗发病率为12.6/10 万,农村粗发病率为24.6/10 万;食管癌死亡病例 18.8 万,我国食管癌粗死亡率为13.7/10万,城市粗死亡率 10.0/10 万,农村粗死亡率18.4/10 万,发病率及死亡率分别列全部恶性肿瘤的第 6 位和第4 位。食管癌的发病有明显的地域差异,高发区主要集中在太行山脉附近区域(河南、河北、山西、山东泰安、山东济宁、山东菏泽),以及安徽、江苏苏北、四川南充、四川盐亭、广东汕头、福建闽南等地区。我国食管癌流行学典型特征为男性发病率高于女性,农村人口发病率高于城市人口。然而,自2000 年开始,无论城市抑或农村,无论男性抑或女性,食管癌发病率均呈现下降趋势,其中女性发病率下降趋势尤其明显。我国食管癌主要的组织学类型为鳞状细胞癌为主,已知其发病与饮食生活习惯密切相关,包括烫食、热茶、饮酒、吸烟等,此外还包括食品霉变、炭烤或烟熏制备方式、饮用水、土壤成分或环境微生物菌群等因素。通过提倡健康生活方式,改变不良饮食习惯,有助于预防食管癌发生;针对高危人群开展早期筛查,有助于提高早期食管癌检出率;各级医疗机构贯彻食管癌早诊早治策略,有助于改善患者长期生存及生活质量;通过规范化诊疗及多学科综合治疗模式进一步提升局部进展期与晚期食管癌患者预后。只有上述多层面医疗措施充分得到执行,才能从根本上减轻我国民众食管癌疾病负担,因此制定并执行食管癌诊疗指南是必要的,需要各专业医务工作者予以高度重视。
4.2 二、食管癌诊断指南
4.2.1 (一)症状体征。
4.2.1.1 1.临床症状
典型临床表现为进行性吞咽困难,进食后梗噎感、异物感、烧灼感、停滞感或饱胀感等,伴或不伴有胸骨后疼痛、反酸、胃灼热、嗳气,起初为进普通饮食困难,随后逐渐恶化为仅可进半流质饮食或流质饮食,可伴或不伴有进食后随即出现食糜或黏液反流、咳黄脓痰、发热、胸闷、喘憋、呕吐、呕血、黑便、胸背部疼痛、声音嘶哑或饮水呛咳等。由于进食困难导致营养摄入不足风险升高,累积数月后可能消瘦、乏力、倦怠、体力减弱等。2.相关体征
早期食管癌通常无明显特异性体征;中晚期阶段可能出现颈部或锁骨上区淋巴结肿大,提示淋巴结转移可能;黄疸、触诊肝肿大或肝区压痛等,提示肝转移可能;胸廓呼吸运动受限,呼吸浅快,肋间隙丰满,气管向健侧移位,患侧语音震颤减弱或消失等,提示恶性胸水可能;腹壁紧张度增加、腹式呼吸运动减弱、叩诊移动性浊音等,提示恶性腹水、腹膜转移可能;近期体重明显减轻、皮褶厚度变薄、舟状腹等,提示营养不良或恶液质。
4.2.2 (二)辅助检查。
4.2.2.1 1. 影像学检查
4.2.2.1.1 (1)CT:
推荐胸段食管癌 CT 扫描常规包含颈、胸、腹部区域;食管胃交界部癌 CT 扫描根据病情可纳入盆腔区域(临床判断必要时)。推荐使用静脉滴注以及口服对比增强,CT 平扫/增强扫描及多角度重建影像,用于判断食管癌位置、肿瘤浸润深度、肿瘤与周围结构及器官的相对关系、区域淋巴结转移以及周围血管侵犯。如果患者有静脉对比剂的禁忌证,则推荐包含相应区域的CT平扫,或者补充颈部或腹部超声检查。
4.2.2.1.2 (2)上消化道造影:
用于评估食管原发肿瘤情况。其对于食管癌的位置和长度判断较直观,但是不能评估原发灶侵犯深度或区域淋巴结转移情况。检查操作指南应至少3 个摄片体位:正位、左前斜位及右前斜位,上界包括下咽,下界达胃幽门以远。
4.2.2.1.3 (3)MRI:
对于 CT 无法判别食管癌原发灶与周围气管及支气管膜部、主动脉外膜临界关系时,MRI 可提供有价值的补充信息。此外,还对诊断肝脏、颅脑、骨骼等远隔转移灶具有临床价值,是否推荐取决于主诊医生判断。体内有金属植入物或幽闭恐惧综合征患者慎用或禁用。
4.2.2.1.4 (4)正电子发射计算机体层成像(positron emissiontomography-computed tomography,PET-CT):
用于辅助诊断、治疗前/后分期、疗效评估,辅助重要临床决策。扫描范围推荐全身扫描(至少包括颅底至 大腿根部 )。合并糖尿 病患者检查前血糖水平需控制在11.1mmol/L 以下,以避免影响显像质量。新辅助治疗后再分期建议同一中心同一仪器重复检查,氟-18- 氟代脱氧葡萄糖(18Ffluorodeoxyglucose,18F-FDG)剂量差异应在20%放射性活度以内,并且注射示踪剂后静息时间差异在15 分钟以内。已知怀孕妇女应权衡检查对临床决策与胎儿发育风险的利弊;哺乳期妇女注射18F-FDG后需暂停母乳喂养 12 小时以上。幽闭恐惧症为相对禁忌证。目前对于最大标准摄取值在诊断与评效环节的阈值尚缺乏共识,因此应结合主诊医师经验进行解读,在设备条件允许的医疗机构可推荐。
4.2.2.1.5 (5)超声检查:
指常规体表超声检查,主要应用于食管癌患者双侧颈区、锁骨上区淋巴结评估(N 分期)及肝脏转移灶评估(M分期)诊断。超声引导下可穿刺活检获得病理学诊断证据。上述颈部及腹/盆腔超声分期检查与诊断医师经验相关,专业资质雄厚的医疗机构可选择。此外,还可用于晚期食管癌患者胸腹腔积液诊断及定位。
4.2.2.2 2. 内镜学检查
4.2.2.2.1 (1)食管普通光镜:
食管癌临床诊断的必要检查项目之一,兼顾食管癌原发病灶大体分型与活检病理学确诊。内镜下分型详见食管癌分类章节内容。存在食管不全或完全梗阻患者,食管内镜可能无法获得肿瘤远端累及信息,可结合上消化道造影或胸部CT/MRI/PET-CT 影像进行判断。
4.2.2.2.2 (2)食管色素内镜:
常用染剂包括碘液、甲苯胺蓝等,可单一染色,也可联合使用。通过喷洒色素对比正常黏膜显示上皮不典型增生或多原发早癌区域,提高 T 分期准确性。
4.2.2.2.3 (3)特殊内镜技术:
利用窄带成像技术结合放大内镜观察食管上皮乳头内毛细血管袢(intrapapillary capillary loops,IPCL)与黏膜微细结构有助于更好地区分病变与正常黏膜及评估病变浸润深度;放大内镜通过直接观察食管黏膜表面形态,根据IPCL 的分型可进一步鉴别病变良恶性及食管病变可能的浸润深度,可指导靶向活检及判断是否符合治疗适应证;激光共聚焦显微内镜(confocal laser endomicroscopy,CLE)可将组织放大至 1000 倍,从微观角度显示细胞及亚细胞结构,在无需活检的情况下即可从组织学层面区分病变与非病变区域,实现“光学活检”的效果;上述特殊内镜技术若医疗设备条件准许可考虑选择。
4.2.2.2.4 (4)食管超声内镜(endoscopic ultrasonography,EUS):
内镜下超声技术有助于显示食管癌原发病灶侵及层次,对于T分期诊断比较重要。此外,EUS 还可评估食管及腹腔干周围淋巴结,EUS引导下细针穿刺活检(endoscopic ultrasonography guided fine-needle aspiration,EUS-FNA)获得病理学确认 N 分期。影像学检查提示管腔狭窄导致EUS 无法通过者,或者存在可疑穿孔患者禁忌。EUS同样受内镜诊断医生经验影响,专业资质雄厚的医疗机构可选择。
4.2.2.3 3. 其他检查
(1)目前缺乏食管癌特异性血液肿瘤标志物,诸如循环肿瘤细胞、循环肿瘤 DNA/RNA、表观遗传学标记物(DNA甲基化、非编码 RNA、组蛋白修饰等)、外泌体等尚处于实验室或临床前研究阶段,除非临床研究范畴内,不推荐常规临床诊疗。
(2)影像学检查疑似食管胸上/中段癌侵犯气管/支气管膜部者,建议具备设备条件的医疗机构进一步行支气管镜/超声支气管镜检查。
(3)具备设备条件的医疗机构可对影像学检查怀疑的气管/支气管周围肿大淋巴结行超声支气管镜下穿刺活检明确病理学诊断。
(4)纵隔镜/胸/腹腔镜下淋巴结切取活检术等全身麻醉下有创性检查可在经多学科讨论后对高选择性患者开展以辅助诊疗决策。
4.2.3 (三)临床诊断。
病理学诊断(金标准)需要食管内镜下活检确诊。存在内镜检查禁忌或者多次尝试活检均未能明确病理诊断者可综合上消化道造影、(颈)胸(腹)部增强 CT、全身PET-CT 或EUS 或超声支气管镜(endobronchial ultrasound,EBUS)引导下穿刺活检辅助诊断。影像学检查可疑转移性淋巴结或远隔脏器应根据医疗条件及操作风险因素经综合评估后,由主诊医生酌情选择合理的活检方式。临床分期诊断应包括(颈)胸/腹(盆)部增强CT,依据医疗条件可选择超声检查、EUS、PET-CT 及MRI 等影像学评估方法。新辅助治疗后再分期诊断仍以治疗前初始临床分期方法为基础,综合医疗条件及操作风险,针对可疑转移性区域淋巴结或远隔脏器可进行有创性活检病理学再确认。
4.2.4 (四)食管癌高危健康人群的筛查。
年龄≥40 岁,来自食管肿瘤高发地区,或有食管肿瘤家族史、食管癌高危因素(吸烟、重度饮酒、头颈部或呼吸道鳞癌、喜食高温及腌制食物、口腔卫生状况不良等)为高危人群,推荐行内镜下食管黏膜碘染色法筛查。若内镜下未见病灶,即定期复查内镜随访。若发现浅表型病灶,取活检评估病理情况。若病理为低级别上皮内瘤变/异型增生,每 3 年随访 1 次;若病理为高级别上皮内瘤变/异型增生、黏膜内癌,并且未发现脉管侵犯,可考虑行内镜下治疗。如果内镜表现较活检病理结果更重,建议行精细食管内镜检查(包括放大内镜、窄光谱成像、染色等)以评估病变情况、决定诊治计划。年龄≥40 岁,具有食管癌高危因素(贲门失弛缓症、腐蚀性狭窄、胼胝症、肥胖)的高危人群,推荐每1~3 年进行1 次内镜下食管黏膜碘染色评估。
对于已知或食管内镜下新发现的具有巴雷特食管高危危险因素的患者,推荐食管内镜下每隔 2cm 行4 点位活检(至少8 块活检组织)。若存在洛杉矶分级诊断为 B、C、D 级别的食管炎,需先规律服用质子泵抑制剂,治疗 8~12 周后再行内镜下诊断;若没有巴雷特食管,则可以终止内镜筛查;若病理诊断为巴雷特食管不伴有异型增生,每隔 3~5 年再次行内镜检查及病理活检;若病理诊断为巴雷特食管伴低级别上皮内瘤变/异型增生,则需行食管内镜下治疗或每年行内镜检查并每隔 1cm 行 4 点位活检;若病理诊断为巴雷特食管合并高级别上皮内瘤变,则需行食管内镜下治疗或外科手术治疗。
4.2.5 (五)食管癌的分类和分期。
4.2.5.1 1. 食管癌的临床分段
4.2.5.1.1 (1)颈段食管:
上自下咽,下达胸廓入口即胸骨上切迹水平。周围毗邻气管、颈血管鞘和脊椎。内镜下通常距门齿15~20cm。
4.2.5.1.2 (2)胸上段食管:
上起胸廓入口,下至奇静脉弓下缘(即肺门水平之上)。其前面被气管、主动脉弓的3 个分支及头臂静脉包围,后面毗邻脊椎。内镜下通常距门齿20~25cm。
4.2.5.1.3 (3)胸中段食管:
上起奇静脉弓下缘,下至下肺静脉下缘(即肺门水平之间)。其前方夹在两肺门之间,左侧与胸降主动脉为邻,后方毗邻脊椎,右侧游离直接与胸膜相贴。内镜下通常距门齿25~30cm。
4.2.5.1.4 (4)胸下段食管
上起自下肺静脉下缘,下至食管胃结合部(即肺门水平之下)。内镜下通常距门齿30~40cm。临床上需综合多种影像学与内镜学检查结果,以病变中心位置所处食管分段进行诊断。
4.2.5.2 2. 食管胃交界部定义
食管胃交界部即食管末端和胃的起始,相当于贲门切迹或腹膜返折水平或食管括约肌下缘,与组织学上的鳞柱交界不一定一致,解剖范围包括胸下段食管、食管胃交界线及胃近端5cm范围。临床诊疗常根据 Siewert 分型,根据病变中心位于食管胃交界线(又称鳞柱交界线、Z 线或 EGJ 线)上下各 5cm 范围内分为:
Siewert Ⅰ型:肿瘤中心位于食管胃交界线以上1~5cm范围内。
Siewert Ⅱ型:肿瘤中心位于食管胃交界线以上1cm至以下2cm范围内。
Siewert Ⅲ型:肿瘤中心位于食管胃交界线以下2~5cm范围内。
若肿瘤累及食管胃交界部,肿瘤中心在食管胃交界部食管侧者或在胃侧 2cm 之内者(Siewert Ⅰ型和Ⅱ型),遵照食管癌分期原则;肿瘤中心在近端胃 2cm 之外(SiewertⅢ型)或肿瘤中心虽在近端胃2cm 之内但未累及食管胃交界部者,遵循胃癌分期原则。
4.2.5.3 3. 浅表型食管癌及癌前病变内镜下分型
我国内镜学分型:隐伏型(充血型)、糜烂型、斑块型和乳头型。国际内镜学分型(2005 年巴黎分型):隆起型病变(0-Ⅰ)、平坦型病变(0-Ⅱ)和凹陷型病变(0-Ⅲ)。0-Ⅰ型又分为有蒂型(0-Ⅰp)和无蒂型(0-Ⅰs)。黏膜内癌通常表现为0-Ⅱb 型、0-Ⅱa型及0-Ⅱc型,病灶表面光滑或呈规则的小颗粒状;而黏膜下癌通常为0-Ⅰ型及0-Ⅲ型,病灶表面呈不规则粗颗粒状或凹凸不平小结节状。详见附录A。
病理学病变层次分类:病变仅局限于上皮内,未突破基底膜者,为 M1 型(高级别上皮内瘤变/重度异型增生;Tis);浅表型食管癌分为黏膜内癌和黏膜下癌:黏膜内癌分为M2 型与M3型;M2型指病变突破基底膜,侵及黏膜层;M3 型指病变侵及黏膜肌层。黏膜下癌根据其侵犯深度可分为 SM1 型、SM2 型、SM3,SM1型指病变侵犯黏膜下层上 1/3;SM2 型指病变侵犯黏膜下层中1/3;SM3型指病变侵犯黏膜下层下 1/3。对于内镜下切除的食管鳞癌标本,以200μm作为区分病变侵犯黏膜下浅层与深层的临界值。
4.2.5.4 4. 进展期食管癌大体分型
髓质型:病变以食管壁增厚为特点,边缘坡状隆起。
4.2.5.5 5. 食管癌病理组织学类型
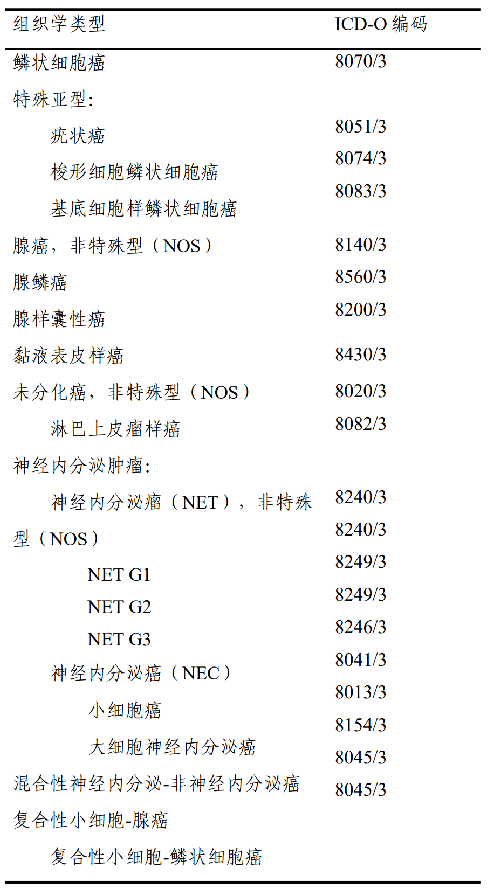
参照 2019 版 WHO 消化系统肿瘤分类,常见病理组织学类型包括鳞癌、腺癌、神经内分泌肿瘤等类型,详见附录B。
4.2.5.6 6. 食管癌国际分期原则
参照国际国际抗癌联盟(Union for International Cancer Control,UICC)/美国癌症联合会(American Joint Committee onCancer,AJCC)第 8 版 TNM 分期体系,将食管原发肿瘤(T)、区域淋巴结(N)、远隔脏器转移(M)及病理分化程度(G)分别定义如下:
4.2.5.6.1 • 原发肿瘤(T)
Tx 原发肿瘤不可评价
T0 没有原发肿瘤的证据Tis 高级别上皮内瘤变/异型增生T1a 肿瘤侵犯黏膜固有层或黏膜肌层T1b 肿瘤侵犯黏膜下层
T2 肿瘤侵犯固有肌层
T4a 肿瘤侵犯临近脏器(可切除),如胸膜、心包、奇静脉、膈肌或腹膜
T4b 肿瘤侵犯临近重要脏器(不可切除),例如主动脉、椎体或气管
4.2.5.6.2 • 区域淋巴结(N)
Nx 区域淋巴结不可评价
N1 1~2 个区域淋巴结转移N2 3~6 个区域淋巴结转移N3 ≥7 个区域淋巴结转移
4.2.5.6.3 • 远处转移(M)
M0 无远处转移
M1 有远处转移
4.2.5.6.4 • 病理分化程度
Gx 分化程度不可评估
G1 高分化
G2 中分化
G3 低分化
根据不同临床情况,分为临床分期(cTNM)、病理分期(pTNM)与诱导治疗后病理分期(ypTNM)3 种类型,具体内容见附录 C。
上述分期原则适用于食管癌,包括鳞状细胞癌、腺癌、腺鳞癌、未分化癌、神经内分泌癌、伴神经内分泌特征的腺癌等,但不适用于食管的神经内分泌瘤及非上皮性肿瘤,如淋巴瘤、肉瘤、胃肠道间质瘤和黑色素瘤等。
4.2.5.7 7. 国际 UICC/AJCC 第 8 版食管癌TNM分期的区域淋巴结分站
1R 右侧颈部气管旁:右侧锁骨上区气管周围至右肺尖部区域1L 左侧颈部气管旁:左侧锁骨上区气管周围至左肺尖部区域
2R 右侧上段气管旁:头臂动脉下缘与气管交汇处至右肺尖部区域
2L 左侧上段气管旁:主动脉弓上缘至左肺尖部区域4R 右侧下段气管旁:头臂动脉下缘与气管交汇处至奇静脉上缘区域
4L 左侧下段气管旁:主动脉弓上缘至隆突水平区域7 隆突下:气管隆突下区域
8U 胸上段食管旁:肺尖部至气管分叉区域8M 胸中段食管旁:气管分叉至下肺静脉下缘区域9R 右侧下肺韧带:右侧下肺韧带内9L 左侧下肺韧带:左侧下肺韧带内15 膈肌:膈肌顶至膈肌脚区域16 贲门旁:紧邻食管胃交界部区域17 胃左动脉:沿胃左动脉走行区域18 肝总动脉:紧邻肝总动脉近端区域19 脾动脉:紧邻脾动脉近端区域20 腹腔:腹腔动脉根部区域
4.2.5.8 8. 日本食道学会(Japan Esophagus Society,JES)第11版食管癌分期的淋巴结分站
JES 关于食管癌的分期系统主要针对食管鳞癌外科手术方案及放疗靶区规划均具有指导意义,因此也对我国广大食管鳞癌患者具有参考价值。
JES 区域淋巴结分站:
颈部淋巴结:颈浅淋巴结(100),颈部食管旁淋巴结(101),颈深淋巴结(102),上部的颈深淋巴结(102up),中部的颈深淋巴结(102mid),咽后淋巴结(103),锁骨上淋巴结(104)
胸部淋巴结:胸上段食管旁淋巴结(105),胸段气管旁淋巴结( 106 ) , 喉 返 神 经 淋 巴 结 (106rec ),左喉返神经淋巴结(106recL ),右喉返神经淋巴结(106recR ),气管前淋巴结(106pre),气管支气管淋巴结(106tb),左侧气管支气管淋巴结(106tbL),右侧气管支气管淋巴结(106tbR),隆突下淋巴结(107),胸中段食管旁淋巴结(108),主支气管淋巴结(肺门淋巴结,109),胸下段食管旁淋巴结(110),膈上淋巴结(111),后纵隔淋巴结(112),胸主动脉前方淋巴结(112aoA),胸主动脉后方淋巴结(112aoP),下肺韧带淋巴结(112pul),动脉韧带淋巴结(113),前纵隔淋巴结(114)。
腹部淋巴结:贲门右淋巴结(1),贲门左淋巴结(2),胃小弯淋巴结(3),沿胃左动脉分支的胃小弯侧淋巴结(3a),胃右动脉第二分支远端的胃小弯淋巴结(3b),左侧胃大弯沿胃短动脉淋巴结(4sa),左侧胃大弯沿胃网膜左动脉淋巴结(4sb),右侧胃大弯沿胃网膜右动脉第二分支至远端淋巴结(4d),幽门上淋巴结(5),幽门下淋巴结(6),胃左动脉淋巴结(7),肝总动脉前上淋巴结(8a),肝总动脉后淋巴结(8p),腹腔干淋巴结(9),脾门淋巴结(10),脾动脉近端淋巴结(11p),脾动脉远端淋巴结(11d),肝十二指肠韧带内沿肝固有动脉淋巴结(12a),肝十二指肠韧带内沿胆总管淋巴结(12b),肝十二指肠韧带内沿门静脉淋巴结(12p),胰头后淋巴结(13),肠系膜上静脉淋巴结(14v),结肠中动脉淋巴结(15),腹主动脉裂孔淋巴结(16a1),腹腔干上缘至左肾静脉下缘之间腹主动周围脉淋巴结(16a2),左肾静脉下缘至肠系膜下动脉上缘之间腹主动脉周围淋巴结(16b1),肠系膜下动脉上缘至腹主动脉分叉之间腹主动脉周围淋巴结(16b2),胰头前淋巴结(17),胰腺下缘淋巴结(18),膈下淋巴结(19),膈肌食管裂孔淋巴结(20)。
4.2.6 (六)食管癌患者的营养评估。
食管癌诊疗初始阶段即需重视患者营养评估,也是基线期综合评估的重要组成部分。营养评估包括营养风险筛查与营养评定两部分。
4.2.6.1 1. 营养风险筛查
营养风险筛查是应用营养风险筛查工具判断患者是否具有可能影响临床结局的营养相关风险的过程。目前临床常用营养风险筛查2002(Nutritional Risk Screening 2002,NRS2002)工具等。患者入院后24 小时内应由受过培训的医师、营养师、药师及护师等应用NRS2002 进行营养风险筛查。有营养风险者,需针对性制定营养诊断与干预计划;无营养风险患者,应于7 日后再次行营养风险筛查。择期手术者,营养风险筛查时间应提前至术前10 日以上。NRS2002工具包括营养状态受损评分、疾病严重程度评分及年龄评分三部分,详见附录 D。当总评分≥3 分时,即具有“营养风险”,需要制定营养诊断与干预计划。
4.2.6.2 2. 营养评定
营养评定是对有营养风险者进一步了解其营养状况的过程。包括两部分:基本营养评定和营养不良评定。(1)基本营养评定:基本营养评定是有营养风险者均需接受的营养管理项目。评定内容包括:营养相关病史、膳食调查、体格检查(身高、体质量等)、实验室检查(肝肾功能、血糖、血脂、电解质、酸碱平衡等)。上述指标是住院患者常规采集内容,也是制定营养干预计划、开具营养处方及实施监测的必要内容。(2)营养不良评定:营养不良评定涉及营养不良的诊断与分级。推荐根据全球(营养)领导人发起的营养不良诊断标准共识进行营养不良评定。对于营养风险筛查阳性者,如在表现型指标与病因型指标中,至少各自具有 1 项阳性者(附录E),即可诊断为营养不良。此外,也可考虑选择主观全面评定(Subjective Global Assessment,SGA)、患者参与的 SGA 等评定量表。
4.3 二、食管癌治疗指南
4.3.1 (一)外科治疗。
外科治疗是食管癌的主要根治性手段之一。在2000年以前我国食管癌外科治疗的主要入路以左胸入路为主,由于左胸主动脉弓遮挡和弓上三角狭小导致上纵隔淋巴结清扫不完全,因此,食管癌左胸入路治疗后下颈和上纵隔淋巴结复发率高达30%~40%,严重影响长期生存。导致我国以左胸入路外科治疗食管癌术后5 年生存率近30年来一直徘徊在 30%~40%。随着近年我国食管癌规范化治疗的进步和食管癌胸、腹腔镜微创手术的推广应用,右胸入路逐渐增多。右胸入路由于没有主动脉弓的遮挡,淋巴结清扫较为彻底。大部分医院颈部淋巴结清扫为选择性。相比较左胸入路,经右胸入路行完全胸、腹二野或颈、胸、腹三野淋巴结清扫能降低术后颈部和胸部淋巴结转移复发率,可明显提高 5 年生存率。此外,局部进展期食管癌的单纯外科治疗模式已经被以手术为主的多学科综合治疗模式替代,后者包括术前新辅助与术后辅助治疗,涉及化疗、放化疗与免疫治疗等。本章节仅聚焦外科治疗相关指南内容。
4.3.1.1 1. 手术治疗原则
(1)外科可切除性需由食管外科经验丰富的胸外科医师评估后判定,包括手术入路及淋巴结清扫策略,以达到包括原发肿瘤及区域淋巴结在内的根治性切除目标。
(2)外科治疗方案应在将食管癌疾病情况(包括食管癌累及部位与临床分期)、患者合并症、手术者习惯等因素综合考虑的前提下谨慎制定。
(3)手术入路选择:对胸段食管癌推荐经右胸入路手术。对上纵隔无淋巴结转移的食管胸中下段癌,也可选择经左胸入路等手术。
(4)可选择的手术方式:可选择传统开放式或腔镜辅助或机器人辅助下的 McKeown 食管癌切除术(经右胸游离食管+经上腹游离胃+颈部吻合术),Ivor Lewis 食管癌切除术(经上腹游离胃+经右胸游离食管+胸内吻合术),Sweet 食管癌切除术(经左胸游离食管+经膈肌游离胃+胸内或颈部吻合术),左胸腹联合切口+颈部或胸部吻合,联合胸、腹二野或颈、胸、腹三野淋巴结清扫术。对于不耐受经胸手术的 cT1~2N0 期食管癌患者,可选择经膈肌裂孔食管内翻拔脱术等多种术式。对于食管胃交界部癌,依据Siewert 分型进行术式选择:Siewert Ⅰ型参照食管外科术式;Siewert Ⅲ型参照胃外科术式;Siewert Ⅱ型外科治疗争议较大,目前更多是根据胸外科与胃肠外科医生的手术习惯及不同熟练程度共同决定。
(5)可采用的淋巴结清扫方式:若颈部区域无可疑转移淋巴结,则对于食管胸中下段癌建议行胸、腹完全二野淋巴结清扫(常规胸腹二野+上纵隔区域淋巴结,特别是双侧喉返神经链周围的区域淋巴结);若颈部区域有可疑转移淋巴结,或者食管胸上段癌,则推荐颈、胸、腹三野淋巴结清扫术(双侧下颈区+ 双侧锁骨上区+上述完全二野淋巴结)。
(6)可选用的代食管器官及上消化道重建路径:最常用的代食管器官可选择胃、结肠及空肠;是否需要带蒂血管行显微外科吻合应酌情考虑。上消化道重建路径可选择原食管床、胸骨后或胸骨前。
(7)食管外科手术数量及相关专业团队规模是影响食管癌围术期并发症率及死亡率的重要因素之一,故推荐在经验丰富的食管癌诊疗大中心或接受规范化培训合格的医师治疗组实施食管癌切除术。
4.3.1.2 2. 外科术后随访指南
术后 2 年内 3 个月复查 1 次,2~5 年每半年复查1 次,5年以后每年复查 1 次。复查项目包括颈/胸/腹部CT 或颈部及腹部超声及各项实验室检查。上消化道造影、全身PET-CT、骨扫描、颅脑MRI等影像学检查与上消化道内镜检查可根据患者术后病情变化作为选择性检查项目。随访期间发现可疑复发或转移病灶,可酌情行病理学活检明确诊断。
4.3.2 (二)放射治疗。
放射治疗是食管癌综合治疗的重要组成部分,涉及术前新辅助、术后辅助、根治性及姑息性治疗多个方面。对于 cTis~2 N1~3 M0 或 cT3~4a Nany M0 期食管癌拟行手术者,推荐术前新辅助放化疗以提高根治性切除率、病理完全缓解率、局部肿瘤控制率,进而改善术后长期生存;非计划手术或拒绝手术治疗者,推荐行根治性同步放化疗;术后经病理学评估为非根治性切除(R1或 R2),或者虽为 R0 切除,但为(y)pT4 Nany M0 期者,可根据患者恢复情况考虑行术后辅助同步放化疗。浅表型食管癌经内镜下食管黏膜切除术,病理学评估为T1b期或T1a 期合并脉管癌栓、神经受累、低分化或未分化癌或非R0切除者,首选食管切除术,经外科评估不适合手术或拒绝手术者,可考虑行辅助放疗或同步放化疗;经外科评估不可切除的cT4bNanyM0期食管癌患者,或拒绝手术治疗者,推荐行根治性同步放化疗。术后局部复发、晚期食管癌合并食管梗阻、广泛性淋巴结转移、合并远隔脏器转移(肺、骨、脑等)经全身系统性药物治疗后评估疾病稳定或退缩者,可考虑姑息性放射治疗。
4.3.2.1 1. 放疗方案制定指南
4.3.2.1.1 (1)放射治疗技术:
建议采用三维适形放疗或调强放疗技术,优选后者。已有多个放射物理方面的研究表明,相较于早年的常规二维放疗技术,三维适形或调强放疗在靶区剂量分布和正常组织器官保护等方面均表现优异,特别是对于心脏和肺的保护,可降低放疗相关不良反应。
4.3.2.1.2 (2)CT 模拟定位:
采取仰卧位,双臂伸直置于体侧或者双手交叉抱肘置于额前。颈段及上段患者建议头颈肩罩固定,中下段及食管胃交界癌体膜固定。行静脉造影增强扫描,层厚0.5cm。有对比剂过敏史者可不行增强扫描。
食管下段及食管胃交界癌,或者需要照射胃左、腹腔淋巴结的患者,为了减少胃部充盈大小造成的照射体积差异,CT模拟定位前空腹 3~4 小时,CT 扫描前及每次放疗前15 分钟,患者需服用200~300ml 半流质饮食(如稠粥、酸奶等,每次定量)。术后残胃位于纵隔的患者,不要充盈胃,以胃内无内容物时定位为佳,放疗时亦如此。
4.3.2.1.3 (3)靶区定义:
1)术前新辅助同步放化疗或根治性同步放化疗:目前尚无食管癌放疗靶区规范,建议根据根治性放疗靶区设计原则勾画新辅助放疗靶区。勾画靶区时需考虑后续食管切除术计划吻合口位置,应尽量避免吻合口位于射野内。
大体肿瘤靶区(Gross Tumor Volume,GTV)及淋巴结靶区(Gross Tumor Volume — Lymph Node,GTVnd):结合各项治疗前临床评估可见的食管癌原发肿瘤为GTV,确诊转移或不能除外转移的淋巴结为 GTVnd。
临床靶区(Clinical Target Volume,CTV):
①颈段/胸上段食管癌:GTV 上下外扩 3cm,GTVnd 三维外扩0.5~1cm。一般需包括中颈、1(下颈、双侧锁骨上)、2、4、7 淋巴结引流区。颈段可不包括 7 区。相离较远的靶区可考虑累及野照射,如上段食管癌伴腹腔淋巴结转移。
②胸中段食管癌:GTV 上下外扩3cm,GTVnd三维外扩0.5~1cm。一般需包括 1、2、4、7、部分8 淋巴结引流区。因中段食管癌腹腔淋巴结转移概率亦比较高,部分患者可能需要照射15、16、17 甚至是 20 区。
③胸下段食管癌/SiewertⅠ/SiewertⅡ型食管胃交界癌:GTV 上下外扩 3cm,GTVnd 三维外扩0.5~1cm,一般需包括7、8、15、16、17、20 淋巴结引流区,部分患者可能需要包括18、19区的近端。相离较远的靶区可考虑累及野照射,如下段食管癌伴1区淋巴结转移。
计划靶区(Planning Target Volume,PTV):根据实际摆位误差决定,一般在 CTV 的基础上三维外扩0.5cm形成,头颈肩网罩固定的颈段或胸上段食管癌可外扩 0.3cm。
PGTV(采用序贯或同步加量时):GTV+GTVnd 三维外扩0.5cm。2)术后辅助放疗/同步放化疗:需包括吻合口情况:原发于颈段或上段食管癌,或切缘距肿瘤≤3cm。
GTV 及 GTVnd:R1 或 R2 切除后,GTV 包括残留的原发肿瘤、切缘阳性的吻合口,GTVnd 包括残留的淋巴结。
CTV:①颈段/胸上段食管癌:包括GTV+GTVnd(如有),吻合口、1、2、4、7 淋巴结引流区。颈段可不包括7 区。T4b需包括瘤床。②胸中段食管癌:包括 GTV+GTVnd(如有),1、2、4、7、部分8淋巴结引流区。根据病理结果酌情包括15、16、17、20淋巴结引流区。T4b 需包括瘤床。③胸下段食管癌/SiewertⅠ/SiewertⅡ型食管胃交界癌:包括 GTV+GTVnd(如有),1、2、4、7、8、15、16、17、20 淋巴结引流区。T4b 需包括瘤床。
PTV:根据实际摆位误差决定,一般在CTV的基础上外扩0.5cm形成,头颈肩网罩固定的颈段或上段食管癌可外扩0.3cm。
PGTV(有肿瘤或淋巴结残存需序贯或同步加量时):GTV+GTVnd 外扩 0.5cm。
4.3.2.2 2. 处方剂量指南
4.3.2.2.1 (1)术前新辅助放疗/同步放化疗:
95%PTV40~50Gy/1.8~2.0Gy,每日 1 次,每周 5 次。有条件的单位也可采用同步加量技术。
4.3.2.2.2 (2)术后辅助放疗/同步放化疗:
R0 术后:95%PTV 50~54Gy/1.8~2.0Gy,每日1 次,每周5次。R1/2 术 后 : 95%PTV 50Gy/1.8~2.0Gy ,序贯95%PGTV10Gy/1.8~2.0Gy,每日 1 次,每周5 次。有条件的单位也可采用同步加量技术。
4.3.2.2.3 (3)根治性放疗/同步放化疗:
①95%PTV60Gy/1.8~2.0Gy,每日 1 次,每周 5 次。
② 95%PTV 50Gy/1.8~2.0Gy,序贯95%PGTV10Gy/1.8~2.0Gy,每日 1 次,每周5 次。有条件的单位也可采用同步加量技术。
注:根治性同步放化疗中放疗剂量可酌情降至50~54Gy,目前国内单位多数采用 60Gy。
4.3.2.3 3. 正常组织剂量
对于术后或术前放疗的患者,建议先按足量处方剂量(如95%PTV 60Gy)进行正常组织评估,再按实际处方剂量执行,同时确定正常组织的实际受量。
(1)双肺:平均剂量<14Gy~16Gy,V20≤28%,V30≤20%;同步放化疗者 V20≤25%;已行免疫药物治疗的患者肺受量尽量低。
(2)心脏:V30<40%,V40<30%
(4)胃:V40<40%,Dmax<55~60Gy
(5)小肠:V40<40%,Dmax<55Gy
(6)双肾:V20<30%
(7)肝:V30<30%
4.3.2.4 4. 同步化疗方案
4.3.2.4.1 (1)紫杉醇+铂类:
紫杉醇 45~60mg/m2,静脉滴注,第1 天。顺铂 20~25mg/m2,静脉滴注,第1 天[或卡铂浓度-时间曲线下面积(area under the concentration-time curve,AUC)=2,静脉滴注,第1 天)。
每周重复
4.3.2.4.2 (2)顺铂+氟尿嘧啶或卡培他滨或替吉奥:
由于卡培他滨或替吉奥疗效与氟尿嘧啶相似或更优,副作用较轻,并且口服方便,可代替氟尿嘧啶。
卡培他滨 800mg/m2,静脉滴注,每日2 次,第1~5天;或替吉奥 40~60mg/m2,口服,每日 2 次,第1~5 天。每周重复
4.3.2.4.3 (3)紫杉醇+氟尿嘧啶或卡培他滨或替吉奥:
紫杉醇 45~60mg/m2,静脉滴注,第1 天。卡培他滨 625~825mg/m2,静脉滴注,每日2 次,第1~5天;或替吉奥 40~60mg/m2,口服,每日 2 次,第1~5 天。每周重复
4.3.2.4.4 (4)奥沙利铂+氟尿嘧啶或卡培他滨或替吉奥(推荐腺癌):
奥沙利铂 85mg/m2,静脉滴注,第1、15、29 天。卡培他滨 625mg/m2,静脉滴注,每日2 次,第1~5天;或替吉奥 40~60mg/m2,口服,每日 2 次,第1~5 天。每周重复疗效评估详见附录 F。
4.3.2.5 5. 放疗后评估及随访指南
(1)术前新辅助放疗后评估:推荐于术前新辅助放疗结束1个月后评估疗效,复查项目包括增强CT(包含颈部、胸部及腹部区域)及血常规、生化等实验室检查。上消化道造影、全身PET-CT、骨扫描、颅脑 MRI 可根据病情选择;为准确临床再分期需要,酌情可考虑行食管内镜重复活检、纤维支气管镜检及EBUS 引导下经支气管镜针吸活检术(endobronchial ultrasoundguidedtransbronchial needleaspiration,EBUS-TBNA)或 EUS-FNA 区域肿大淋巴结再次活检等有创性检查。建议在放疗结束后 4~8 周实施食管癌根治术。
(2)术后辅助放疗后随访:推荐于术后辅助放疗结束后3个月开始随访,推荐频次为初始 2 年内3 个月复查1 次,2~5年每半年复查 1 次,5 年以后每年复查 1 次。包括增强CT(包含颈部、胸部及腹部区域)及血常规、生化等实验室检查。上消化道造影、全身PET-CT、骨扫描、颅脑 MRI 可根据病情选择;随访期间若发现吻合口、区域淋巴结或远隔脏器可疑转移灶,酌情可考虑行上消化道内镜检查、纤维支气管镜检及 EBUS-TBNA 或EUS-FNA区域肿大淋巴结有创性检查。
(3)根治性放化疗后随访:推荐于根治性放化疗结束后1~2个月开始,随访,推荐频次为初始 2 年内3 个月复查1 次,2~5年每半年复查 1 次,5 年以后每年复查 1 次。包括增强CT(包含颈部、胸部及腹部区域)及血常规、生化等实验室检查。上消化道造影、全身PET-CT、骨扫描、颅脑 MRI 可根据病情选择;随访期间若发现吻合口、区域淋巴结或远隔脏器可疑转移灶,酌情可考虑行上消化道内镜检查、纤维支气管镜检及 EBUS-TBNA 或EUS-FNA区域肿大淋巴结有创性检查。
4.3.3 (三)系统性药物治疗。
早期食管癌的临床症状不明显,难于发现;大多数食管癌患者在确诊时已为局部晚期或存在远处转移。因此,以控制播散为目的的系统性药物治疗在食管癌的治疗中占有重要的地位。近年来,随着分子靶向治疗、免疫治疗新药的出现和发展,药物治疗在食管癌综合治疗中的作用前景广阔。
目前,药物治疗在食管癌中主要应用领域包括针对局部晚期患者的新辅助治疗和辅助治疗,以及针对晚期患者的化疗、分子靶向治疗和免疫治疗。
4.3.3.1 1.新辅助治疗:
新辅助化疗有利于肿瘤降期、消灭全身微小转移灶,并观察肿瘤对该化疗方案的反应程度,指导术后化疗。对于食管鳞癌,可手术切除的局部晚期患者可考虑行新辅助化疗,包括cTis~2 N1~3 M0 或 cT3~4a Nany M0 期颈、胸段食管癌。可手术切除的局部晚期食管下段及食管胃交界部腺癌推荐围手术期化疗或新辅助化疗,包括 cTis~2 N1~3 M0 或 cT3~4aNany M0 期或可疑cT4b期食管胃交界部腺癌。
4.3.3.2 2.术后辅助治疗:
食管鳞癌根治性术后是否常规进行辅助化疗仍存在争议,对于存在高危因素(T4a 及N1~3 期)的患者可考虑行辅助化疗或放化疗。食管下段及食管胃交界部腺癌术后辅助化疗的证据来自于围手术期化疗的相关研究,对于术前行新辅助化疗并完成根治性手术的患者,术后可沿用原方案行辅助化疗。对于术前接受过新辅助放化疗的食管癌和食管胃交界部癌(包括鳞癌和腺癌)患者,在根治术后如未达到病理完全缓解,接受纳武利尤单抗治疗 1 年可显著延长无病生存。目前,国家药品监督管理局尚未批准纳武利尤单抗用于食管或食管胃交界部癌辅助治疗的适应证,待获批后可作为推荐的治疗策略。辅助治疗一般在术后4周以后开始。
4.3.3.3 3.复发/转移性食管癌的药物治疗:
对初诊晚期转移性食管癌患者,如能耐受,可行系统性药物治疗。转移性食管癌经全身治疗后出现疾病进展,可更换方案治疗。对根治性治疗后出现局部复发或远处转移的患者,如能耐受,可行系统性药物治疗。
4.3.3.3.1 (1)一线治疗:
目前,免疫检查点抑制剂联合化疗已经成为晚期食管癌一线治疗的标准。对于晚期食管癌和食管胃交界部癌(包括鳞癌和腺癌)的患者,一线治疗可在顺铂+氟尿嘧啶化疗方案的基础上联合帕博利珠单抗;对于晚期食管胃交界部腺癌患者,一线治疗可在奥沙利铂+氟尿嘧啶类药物的基础上联合纳武利尤单抗;对于晚期食管鳞癌患者,一线治疗可在紫杉醇+顺铂化疗的基础上联合卡瑞利珠单抗。对于不适合接受免疫检查点抑制剂治疗的患者,可考虑行单纯化疗。晚期食管鳞癌的常用化疗方案包括顺铂联合氟尿嘧啶、紫杉醇联合铂类药物等。晚期食管胃交界部腺癌的常用化疗方案为顺铂或奥沙利铂联合氟尿嘧啶类药物;对于体力状况良好的患者,一线治疗也可以考虑紫杉类药物联合铂类以及氟尿嘧啶类药物的三药联合方案。对于 HER-2 阳性的晚期食管胃交界部腺癌患者,一线治疗可在顺铂+氟尿嘧啶类药物的基础上联合曲妥珠单抗。
4.3.3.3.2 (2)二线及以后治疗:
免疫检查点抑制剂已成为化疗失败的晚期食管癌患者的重要治疗选择。对于一线化疗失败的晚期食管鳞癌患者,可选择卡瑞利珠单抗或替雷利珠单抗作为二线治疗药物。目前,国家药品监督管理局尚未批准替雷利珠单抗用于晚期食管或食管胃交界部癌二线治疗的适应证,待获批后可作为推荐的治疗策略。对于一线化疗失败的PD-L1CPS≥10 的食管鳞癌患者,二线治疗可选择帕博利珠单抗单药;对于至少二线化疗失败的食管胃交界部腺癌患者,三线及以后的治疗可以选择纳武利尤单抗。
晚期食管胃交界部腺癌患者二线治疗的选择包括紫杉醇单药,或伊立替康单药,或多西他赛单药化疗。晚期食管鳞癌的二线化疗无标准方案,如不适合接受免疫检查点抑制剂治疗,临床实践中可参考腺癌的方案进行化疗。
在靶向治疗方面,对于 HER-2 阳性的晚期食管胃交界部癌,三线及以后的治疗可选择维迪西妥单抗。抗血管生成的靶向药物也可以作为治疗选择:晚期食管胃交界部癌的三线及以后治疗可选择阿帕替尼;晚期食管鳞癌二线及以后治疗可选择安罗替尼或阿帕替尼。
4.3.3.4 4. 系统性药物治疗前相关检查评估
4.3.3.4.1 (1)评估肿瘤情况:
通过病理和细胞学明确病理类型,通过病史、体格检查、影像学检查明确疾病的范围、发展趋向,以确定治疗目标。治疗前应行影像学评估,视具体情况留作基线资料,方便治疗后对比疗效或长期随访。
4.3.3.4.2 (2)评估患者身体条件:
患者应当一般状况良好,ECOGPS评分 0~1 分。详见附录 G。
治疗开始前 1 周内行血常规、肝肾功能、心电图等检查。心、肝、肾和造血功能无明显异常。血常规中性粒细胞绝对值≥1.5×109/L、血小板≥80×109/L、HGB≥80g/L 可考虑治疗。
4.3.3.4.3 (3)评估合并疾病情况:
患者应无活动性消化道穿孔出血、胃肠梗阻、肺栓塞、休克等严重并发症。若合并非肿瘤性发热,体温应<38℃。
如患者合并心、肺或其他慢性内科疾病,可根据病情进行相关检查,如:心肌酶谱、脑钠肽、24 小时动态心电图、超声心动图、肺功能检查等。
4.3.3.5 5. 常用系统性药物治疗方案
4.3.3.5.1 (1)术前新辅助治疗:
1)氟尿嘧啶+亚叶酸+奥沙利铂+多西他赛(FLOT)(推荐腺癌):奥沙利铂 85mg/m2静脉滴注、第1天,多西他赛50mg/m2静脉滴注、第 1 天,亚叶酸 200mg/m2 静脉滴注、第1 天,5-氟尿嘧啶2600mg/m2 持续静脉滴注 24 小时、第1天,每2 周重复,术前、术后各 4 个周期。
①方案一:5-氟尿嘧啶 800mg/m2持续静脉滴注24 小时、第1~5天,顺铂 100mg/m2静脉滴注、第 1 天,每4 周重复,术前2~3个周期,术后 3~4 个周期(推荐腺癌)。②方案二:5-氟尿嘧啶 1000mg/m2持续静脉滴注24 小时、第1~4 天,顺铂 80mg/m2静脉滴注、第1 天,每3 周重复,术前2个周期。③方案三:5-氟尿嘧啶 800mg/m2持续静脉滴注24 小时、第1~5天,顺铂 80mg/m2 静脉滴注、第 1 天,每3 周重复,术前2个周期(推荐鳞癌)。
3)紫杉醇+顺铂(TP)(推荐鳞癌):①方案一:紫杉醇 150mg/m2 静脉滴注、第1 天,顺铂50mg/m2静脉滴注、第 1 天,每 2 周重复。
②方案二:紫杉醇 135mg/m2 静脉滴注、第1 天,顺铂70mg/m2静脉滴注、第 1 天,每 3 周重复。4)多西他赛+顺铂+氟尿嘧啶(DCF)(推荐鳞癌):多西他赛70mg/m²静脉滴注、第 1 天,顺铂70mg/m²静脉滴注、第1天,5-氟尿嘧啶 750 mg/m²静脉滴注、第 1~5 天,每3 周重复。
4.3.3.5.2 (2)术后辅助治疗:
1)纳武利尤单抗:纳武利尤单抗240mg 静脉滴注、第1天,每2 周重复,治疗 16 周;然后,纳武利尤单抗480mg 静脉滴注、第1天,每 4 周重复。总治疗时长不超过1 年。(注:目前,国家药品监督管理局尚未批准纳武利尤单抗用于食管或食管胃交界部癌辅助治疗的适应证,待获批后可作为推荐的治疗策略。)
2)紫杉醇+顺铂(TP)(推荐鳞癌):紫杉醇150mg/m2静脉滴注、第 1 天,顺铂 50mg/m2静脉滴注、第1 天,每2 周重复。
4.3.3.5.3 (3)晚期一线治疗:
1)氟尿嘧啶+顺铂(PF):5-氟尿嘧啶750~1000mg/m2持续静脉滴注 24 小时、第 1~4 天,顺铂 70~100mg/m2静脉滴注4小时、第1天,每 3~4 周重复。
①方案一:紫杉醇 135~175 mg/m²静脉滴注3 小时、第1天,顺铂 75 mg/m²静脉滴注、第 1 天,每3 周重复。
②方案二:紫杉醇 90~150 mg/m² 静脉滴注3 小时、第1天,顺铂50 mg/m²静脉滴注、第 1 天,每 2 周重复。
③方案三:白蛋白结合型紫杉醇125 mg/m²静脉滴注、第1、8天,顺铂 75 mg/m²静脉滴注、第 1 天,每3 周重复。
3)奥沙利铂+亚叶酸钙+氟尿嘧啶(FLO)(推荐腺癌):奥沙利铂 85 mg/m²静脉滴注 2 小时、第1 天,亚叶酸钙200mg/m²静脉滴注 2 小时、第 1 天,之后用 5-氟尿嘧啶2600 mg/m²持续静脉滴注24小时、第 1 天,每 2 周重复。
4)多西他赛+顺铂+氟尿嘧啶(改良的DCF 方案)(推荐腺癌):多西他赛 40 mg/m²静脉滴注 1 小时、第1 天,顺铂40mg/m²静脉滴注1~3 小时、第 3 天,5-氟尿嘧啶 2000 mg/m²持续静脉滴注48小时、第1 天,每 2 周重复。
5)伊立替康+氟尿嘧啶/亚叶酸钙(推荐腺癌):伊立替康180mg/m²静脉滴注 30 分钟、第 1 天,亚叶酸钙400mg/m² 静脉滴注、第1 天,5-氟尿嘧啶 400 mg/m² 静脉推注、第1 天,5-氟尿嘧啶1200mg/m² 持续静脉滴注 24 小时、第 1~2 天,每2 周重复。
6)帕博利珠单抗+氟尿嘧啶+顺铂:帕博利珠单抗200mg静脉滴注、第 1 天,5-氟尿嘧啶 800mg/m2 静脉滴注、第1~5天,顺铂80mg/m2静脉滴注、第 1 天,每 3 周重复。
①方案一:纳武利尤单抗 360 mg 静脉滴注、第1 天,卡培他滨1000 mg/m2口服、每日 2 次、第 1~14 天,奥沙利铂130mg/m2静脉滴注、第 1 天,每 3 周重复。
②方案二:纳武利尤单抗 240 mg 静脉滴注、第1 天,奥沙利铂85 mg/m2静脉滴注、第 1 天,亚叶酸400mg/m2静脉滴注、第1天,5-氟尿嘧啶 400mg/m2静脉滴注、第1 天,5-氟尿嘧啶1200mg/m2持续静脉滴注 24 小时、第 1~2 天,每2 周重复。
8)卡瑞利珠单抗+紫杉醇+顺铂(推荐鳞癌):卡瑞利珠单抗200mg 静脉滴注、第 1 天,紫杉醇175mg/m2静脉滴注、第1天,顺铂 75mg/m2静脉滴注、第 1 天,每3 周重复。
4.3.3.5.4 (4)晚期二线及后线治疗:
1)卡瑞利珠单抗单药:卡瑞利珠单抗200mg 静脉滴注、第1天,每 2 周重复。
2)帕博利珠单抗单药:帕博利珠单抗200mg 静脉滴注、第1天,每 3 周重复。
3)纳武利尤单抗单药:纳武利尤单抗3mg/kg 静脉滴注、第1天,每 2 周重复。(注:目前,国家药品监督管理局仅批准纳武利尤单抗用于晚期或复发性食管胃交界部腺癌及胃癌的三线治疗,尚未批其用于晚期食管鳞癌二线及后线治疗的适应证。)
4)替雷利珠单抗单药:替雷利珠单抗200mg 静脉滴注、第1天,每 3 周重复。(注:目前,国家药品监督管理局尚未批准替雷利珠单抗用于晚期食管或食管胃交界部癌二线治疗的适应证,待获批后可作为推荐的治疗策略。)
5)紫杉类单药:
①方案一:紫杉醇 175mg/m2静脉滴注、第1 天,每3周重复。②方案二:白蛋白结合型紫杉醇100~150mg/m2静脉滴注、第1、8 天,每 3 周重复。
③方案三:多西他赛 75~100mg/m2静脉滴注、第1 天,每3周重复。
6)伊立替康单药:伊立替康 150~180mg/m2静脉滴注、第1天,每 2 周重复。
7)伊立替康联合替吉奥:伊立替康160mg/m2静脉滴注、第1天,替吉奥 40~60mg 口服、每日 2 次、第1~10 天,每2 周重复。
8)阿帕替尼(推荐腺癌):阿帕替尼250~500mg 口服,连续服用。
4.3.3.6 6. 治疗相关不良反应的防治
治疗期间应根据治疗方案的不良反应特点,定期进行实验室检查,必要时应给予相应的对症支持治疗。骨髓抑制、胃肠道反应、肝肾功能损害是化疗相对常见的不良反应。免疫治疗和靶向治疗药物的毒性谱与化疗有所不同,治疗过程中应予以关注。
(1)骨髓抑制:建议患者于化疗后每周复查1~2 次血常规。根据具体化疗方案及患者血常规变化的特点,复查时间间隔可酌情增减。若出现 3、4 度白细胞或中性粒细胞降低应停药,对症给予粒细胞集落刺激因子、粒细胞巨噬细胞集落刺激因子治疗,并视具体情况延迟或减量下一周期化疗。当血小板<50×109/L 时应给予白介素11或重组人血小板生成素等药物治疗,酌情使用止血药物。根据患者的血常规结果和化疗方案的特点,也可预防性使用上述升白细胞及升血小板药物。
(2)胃肠道反应:化疗相关恶心呕吐:可发生于化疗后数小时或数天。可单独或联合应用 5-羟色胺3 受体拮抗剂类、糖皮质激素及神经激肽-1 受体拮抗剂等药物。甲氧氯普胺与苯海拉明连用,可提高镇吐作用且可控制锥体外系反应。应注意对症纠正严重呕吐造成水电解质紊乱。
食欲下降:尤其是术后患者,手术改变造成消化系统异常,故化疗时更要注意营养支持。可以口服营养制剂和增强食欲的药物,如甲地孕酮等。或者放置胃或空肠营养管并通过营养管进行营养支持,必要时应静脉营养支持。
腹泻:应注意避免进食寒凉和粗纤维丰富的食物,及时服用止泻药。腹泻超过每日 5 次或出现血性腹泻应停止化疗,并注意足量补液及纠正水电解质紊乱。
(3)肝肾功能损害:化疗前应了解患者有无肝炎病史。建议每化疗周期复查 1 次肝肾功能。一旦出现肝功能损害,应当全面评估肝功能,并予以保肝药物治疗。肾功能不全者禁用有肾毒性的药物,在使用肾毒性药物,如顺铂时,应注意足量水化,且需要注意药物间的相互作用。
(4)神经系统毒性:应用奥沙利铂等药物前,须告知患者避免接触寒冷物品,并给予营养神经药物。严重神经毒性应停药。
(5)过敏反应:使用糖皮质激素、H2受体拮抗剂、苯海拉明预处理可降低过敏反应发生的概率。使用易引起过敏的化疗药时,应在给药后 2 小时内密切观察患者的反应,一旦发生过敏,应立即停药,并予以肾上腺素、糖皮质激素、吸氧、升压药等抢救。
(6)免疫相关不良反应:免疫检查点抑制剂可能引发免疫相关不良反应。对于存在自身免疫性疾病病史的患者,在治疗决策时需特别谨慎。对于接受免疫检查点抑制剂单药或联合治疗的患者,必须密切监测。建议所有接受此类药物治疗的患者在治疗期间监测血常规、肝肾功能、心肌酶谱和甲状腺功能;如患者出现疲劳等非特异性症状,应考虑检测促肾上腺皮质激素和皮质醇;如出现呼吸急促、咳痰、发热、胸痛、咯血等症状,应考虑进行胸部影像学检查。如诊断免疫相关不良反应,可根据病情暂停或永久停用免疫检查点抑制剂,并针对不良反应进行治疗。免疫相关性肺炎、心肌炎等严重不良反应可能迅速致命,应特别警惕,必要时应快速、积极地使用糖皮质激素等免疫抑制治疗。
(7)阿帕替尼的主要不良反应:阿帕替尼的常见不良反应包括蛋白尿、白细胞和中性粒细胞减少、高血压、手足综合征、转氨酶升高等。在接受阿帕替尼治疗过程中,应监测血压,并定期进行血常规、肝肾功能、尿常规检查,必要时停药并予以对症治疗。
4.3.3.7 7. 系统性药物治疗后随访
(1)对于可手术切除、接受新辅助化疗的患者,应及时评估疗效。推荐每周期化疗前进行病史询问、体格检查;2~3 个周期后复查影像学评效。如病史、体格检查或影像学检查结果提示疾病进展,应中止化疗,并再次评估肿瘤的可切除性;对于可根治性切除的患者,应及时行手术治疗。
(2)对于根治性术后接受辅助化疗的患者,因无明确观察指标,推荐在完成既定的化疗后行影像学检查。如病情稳定,并且无自觉症状,在治疗结束后的 2 年内,可每3~6 个月进行随访,内容包括病史询问、体格检查、复查影像学评估,并且根据临床需要复查血常规、血生化、食管内镜等项目。自第 3 年起,可每6~12 个月进行随访,内容同上。自第 6 年起,可每年随访1 次,内容同上。
(3)对于转移性食管癌接受姑息性治疗的患者,因中位缓解期短,推荐在完成既定的化疗后行影像学检查。如病情稳定,并且无自觉症状,可每 2 个月进行随访,内容包括病史询问、体格检查、复查影像学评估,并且根据临床需要复查血常规、血生化、食管内镜等项目。
4.3.4 (四)内镜治疗。
4.3.4.1 1.早期食管癌内镜下治疗术前评估
对于无淋巴结转移的早期食管癌推荐行内镜下食管黏膜切除术。若经病理学评估食管癌浸润深度为SM2 或SM3 型,即使临床评估无区域淋巴结转移,也推荐根治性食管外科切除术。因此,术前准确判断肿瘤浸润深度、累及范围及区域淋巴结转移情况是合理治疗决策及预后预测的先决条件。推荐采用色素内镜及电子染色内镜评估病变累及范围;超声内镜、鳞状上皮 IPCL 分型、食管肿瘤内镜下形态学分型等信息综合判断浸润深度。鉴于目前尚缺乏食管内镜学评估指南,并且容易受内镜医生操作经验水平影响,故推荐依靠食管黏膜切除术后病理学评估进行临床决策。
4.3.4.2 2.早期食管癌内镜下治疗原则
与传统食管外科手术相比,内镜下食管黏膜切除术治疗食管癌前病变或早期食管癌的手术创伤较小、围术期并发症风险较低、术后加速康复、医疗经济学效益较高,长期预后近似于根治性食管切除术。内镜下食管黏膜切除术即可兼顾临床诊断与治疗,又可从保留食管脏器角度改善患者生活质量,因此是具有优势的。推荐部分cTis~1aN0M0 期食管癌患者选择,包括食管黏膜重度异型增生、侵犯层次局限于食管黏膜上皮层或黏膜固有层的食管癌(M1、M2);累及黏膜肌层(M3)或黏膜下浅层(SM1)但是不伴脉管瘤栓或神经侵犯,不伴食管周围区域淋巴结肿大者。若病变累及超过3/4 环周管腔,经验丰富内镜医生评估后认为术后食管瘢痕狭窄风险较高者不推荐内镜治疗。
4.3.4.3 3. 内镜下食管黏膜切除方式
主要包括内镜下黏膜切除术(endoscopic mucosal resection,EMR)、多环套扎黏膜切除术(multi-band mucosectomy,MBM)及内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)。
(1)EMR:EMR 指内镜下将食管黏膜病灶整块或分块切除,用于食管浅表型肿瘤的诊断与治疗。方法包括食管黏膜下注射-抬举-切除法的基础上逐渐演变出透明帽法(EMR with a cap,EMRC)、套扎法(EMR with ligation,EMRL)、分片黏膜切除术(endoscopypiecemeal mucosal resection,EPMR)等技术。各种EMR技术的基本原理相同,多是先通过黏膜下注射将食管黏膜下层与固有肌层分离,然后利用不同的方法切除局部隆起的食管黏膜病灶。EMRC 是利用内镜前端安置的透明帽对病变进行吸引,再行圈套切除,对操作技术要求不高,并发症少,但可切除的病变大小受透明帽的限制;EMRL 是先对病变进行套扎,阻断血流并形成亚蒂后切除,视野清晰,出血较少;EPMR 用于传统EMR 不能一次完整切除的较大病灶,将病灶分次部分切除,适用于>2cm的巨大平坦病变,但是分次切除的组织标本体外拼接困难,难以评估根治效果,易导致病变局部残留或复发。
(2)MBM:MBM 是在食管曲张静脉套扎器的基础上改良而来的多块黏膜切除技术,主要包括标记、圈套切除、处理创面等步骤。与 EMR 相比,MBM 不需要行黏膜下注射,可显著缩短操作时间。同时,在保证相同治疗效果的前提下MBM较EMR具有操作简单、成本低、治疗时间短、安全高效的优点,便于在基层推广,应注意规范化操作,避免病变残留。
(3)ESD:ESD 是对不同部位、大小、浸润深度的病变,在进行黏膜下注射后使用特殊电刀逐渐分离黏膜层与固有肌层之间的组织,将病变黏膜及黏膜下层完整剥离的方法。操作大致分为5步:
①病灶周围标记;
②黏膜下注射,使病灶充分抬举;
③部分或环周切开黏膜;
④黏膜下剥离,使黏膜与固有肌层完全分离开,一次完整切除病灶;
经典ESD技术改进后的隧道式黏膜剥离技术(标记-注射-远端开口-近端切开-建立隧道-两边切开)也可用于累及范围较大的食管黏膜病变。
4.3.4.4 4. 内镜治疗常见并发症及处理
虽然内镜下切除属于微创治疗,但是受内镜医师经验水平、设备器械精密度、食管黏膜疾病及患者全身合并症等诸多因素影响,可能术后并发食管黏膜出血、穿孔、狭窄、感染等风险。
4.3.4.4.1 (1)出血:
包括术中出血指术中需要止血治疗(如电凝或止血夹止血)的局部创面出血;术后迟发性出血指操作术后30天内出现呕血、黑便等征象,血红蛋白下降20g/L 以上。EMR出血风险与食管黏膜病变范围呈正相关,病灶直径超过2cm者术中及术后出血风险显著升高,混合电流切除者易发生术中出血,凝固电流切除者易发生延迟性出血。ESD 出血可能与病变部位、大小及类型、剥离层次、病变的黏连程度、血管分布、操作者的熟练程度等相关。
4.3.4.4.2 (2)穿孔:
ESD 术中穿孔风险较EMR 更高,通常可在术中发现。若患者 ESD 术后突发前胸及颈面部皮下气肿,胸部平片或CT发现纵隔气体或查体见穿孔征象等,应考虑术后穿孔。ESD穿孔与操作者经验、病变部位及大小、病变处有无溃疡形成等相关。操作过程中使用 CO2 气体及预防性夹闭肌层破损处可降低穿孔发生率,而创面处肌层暴露则会增加穿孔风险。消化道内积聚大量气体,容易使小的肌层裂伤形成穿孔,因此,操作过程中应及时抽吸消化道内的气体。严格掌握内镜切除适应证、充分的黏膜下注射及选用合适的器械也有利于预防穿孔发生。
4.3.4.4.3 (3)食管狭窄:
指内镜下食管黏膜切除术后需要内镜下治疗的食管管腔狭窄,常伴有不同程度的吞咽困难,多见于术后1个月左右。食管黏膜病变范围、浸润深度、切除创面的环周比例与纵向长度是术后食管狭窄的常见危险因素。大于3/4 环周的食管黏膜病变经内镜切除治疗的术后狭窄发生率可达 88%~100%。
4.3.4.5 5. 内镜下非黏膜切除治疗
4.3.4.5.1 (1)射频消融术:
利用电磁波生物物理中的热效应发挥治疗作用,使肿瘤组织脱水、干燥和凝固坏死,从而达到治疗目的。因其有效治疗深度仅限于 1000μm 范围,因此术后食管穿孔或狭窄风险较低,可用于治疗不耐受外科切除或拒绝手术的多原发、单病灶范围较大(累及全周管腔)的食管癌前病变或早期食管癌。
4.3.4.5.2 (2)光动力疗法、氩离子凝固术、激光疗法、热探头治疗及冷冻疗法:
这些内镜下非切除技术既可单独使用,也可与内镜切除术联合应用。光动力疗法是利用特定激光激发选择性聚集于肿瘤组织的光敏剂产生单态氧,通过物理、化学和免疫等复杂机制导致肿瘤坏死的疗法,可用于处理大面积早期多灶病变,应注意光敏反应、术后穿孔狭窄等并发症风险。氩离子凝固术是一种非接触性热凝固方法,可有效处理食管癌前病变,然而应用于早期食管癌则需严格掌握适应证。非切除治疗方法致肿瘤毁损,但是无法获得组织标本进行病理学评估,也无法判别治疗根治性状态,因此术后仍需要严密随诊,长期预后尚待明确,目前存在食管黏膜切除或消融禁忌证的患者可考虑选择。
4.3.4.6 6. 内镜治疗后随访指南
食管癌前病变及早期食管癌经内镜下食管黏膜切除术后3个月、6 个月与 12 个月各需复查内镜评估1 次,若无复发则以后每年复查内镜 1 次。食管黏膜轻度异型增生患者推荐术后每3 年随访1次,中度异型增生患者推荐术后 1 年随访 1 次。内镜随访时应结合染色和/或放大内镜检查,发现阳性或可疑病灶行选择性活检及病理诊断。食管黏膜病变经内镜下黏膜切除术后应仔细检查创面,必要时使用染色或窄光谱方法进行评估,发现病变残留时应及时行再次食管内镜治疗,有利于降低复发率。局部残留或复发的食管黏膜病变多可通过内镜下治疗清除,内镜下治疗失败者可追加手术或放化疗。此外,食管癌诊疗相关影像学评估方法亦不可忽视,应警惕异时多原发食管鳞癌或第二原发癌(如头颈部鳞癌、胃癌等)。
4.3.5 (五)病理学评估指南。
4.3.5.1 1.标本类型及固定指南
4.3.5.1.1 (1)标本类型:
常见标本类型包括内镜活检标本、EMR/ESD和根治切除术标本。
4.3.5.1.2 (2)标本固定:
应及时、充分固定,采用10%中性缓冲福尔马林固定液(含 4%甲醛),应立即固定(手术切除标本也尽可能半小时内),固定液应超过标本体积的10 倍以上,固定时间6~72小时。
内镜活检标本:标本离体后,应由内镜医师或助手用小拨针将活检钳上的组织立即取下,并应在手指上用小拨针将其展平,取小块滤纸,将展平的黏膜平贴在滤纸上,立即放入固定液中固定。
EMR/ESD 标本:应由内镜医师展平标本,黏膜面向上,使用不生锈的细钢针固定于软木板(或泡沫板)上,避免过度牵拉导致标本变形,亦不应使标本皱褶,标记口侧及肛侧方向,立即完全浸入固定液中。
根治切除术标本:沿肿瘤对侧打开食管壁。黏膜面向上,使用大头针固定于软木板(或泡沫板)上,板上应垫纱布,钉好后黏膜面向下,尽快(离体 30 分钟内)完全浸入固定液中。
4.3.5.2 2.取材及大体描述指南
4.3.5.2.1 (1)查对:
取材时,应核对基本信息,如姓名、送检科室、床位号、住院号、标本类型等。
4.3.5.2.2 (2)活检标本:
1)大体检查及记录:描述送检组织的大小及数目。2)取材:送检黏膜全部取材,应将黏膜包于滤纸中以免丢失,取材时应滴加伊红,利于包埋和切片时技术员辨认。大小相差悬殊的要分开放入不同脱水盒,防止小块活检组织漏切或过切。包埋时需注意一定要将展平的黏膜立埋(即黏膜垂直于包埋盒底面包埋)。一个蜡块中组织片数不宜超过 3 片、平行方向立埋(由于食管癌前病变及早期癌多较平坦,而对食管癌前病变程度及早期癌的判断要看异型细胞累及鳞状上皮层次的比例、是否有黏膜固有层浸润,对组织层次清晰度要求较高。只有做好上述展平和立埋这两步骤,才能保证切片上活检组织的层次分明,这对食管早期癌及癌前病变的准确诊断至关重要)。蜡块边缘不含组织的白边尽量用小刀去除,建议每张玻片含6~8 个连续组织片,便于连续观察。
4.3.5.3 3.EMR/ESD 标本
4.3.5.3.1 (1)大体检查及记录:
测量并记录标本大小(最大径×最小径×厚度),食管胃交界部标本要分别测量食管和胃的长度和宽度。记录黏膜表面的颜色,是否有肉眼可见的明显病变,病变的轮廓是否规则,有无明显隆起或凹陷,有无糜烂或溃疡等,记录病变的大小(最大径×最小径×厚度)、大体分型以及病变距各切缘的距离(至少记录病变与黏膜侧切缘最近距离)。多块切除的标本宜由手术医师根据内镜下病变的轮廓/碘不染色轮廓(食管鳞状上皮病变)在标本固定前进行重建。复杂标本建议临床病理沟通或由手术医师提供标本延展及重建的示意图。
4.3.5.3.2 (2)取材:
EMR/ESD 标本应全部取材。宜涂碘(从固定液中取出并至少冲水半小时以上再做碘染色)识别病变(碘不染色区)和最近侧切缘。垂直于最近侧切缘取材。黏膜侧切缘与基底切缘可用墨汁或碳素墨水标记(有条件的可于口侧和肛侧涂不同颜色以便于辨别),以便在镜下观察时能够对切缘做出定位,并评价肿瘤切缘情况。食管胃交界部标本宜沿口侧-肛侧的方向取材,以更好的显示肿瘤与食管胃交界的关系。每间隔 2~3mm 平行切开,全部取材。如果标本太大,可以进行改刀,将一条分为 n 条,分别标记a、b 等。按同一方向立埋(包埋第一块和最后一块的刀切面,如果第一块和最后一块镜下有病变,再翻转 180°包埋,以确保最终切片观察黏膜四周切缘情况),并记录组织块对应的包埋顺序/部位。记录组织块对应的部位(建议附照片或示意图并做好标记)。建议将多块切除的标本分别编号和取材,不需考虑侧切缘的情况,其他同单块切除标本。
4.3.5.4 4.根治切除术标本指南
4.3.5.4.1 (1)大体检查及记录:
取材时记录切除食管长度,可见或未见食管胃交界部,如果有则记录胃的长度。肿瘤部位(结合手术及内镜检查):颈段、胸上段食管、胸中段食管、胸下段食管、食管胃交界部。记录肿瘤距口侧切缘和肛侧切缘及环周切缘的距离。肿瘤大体分型(包括外观描写)、大小、切面颜色、质地;浸润深度;累及/未累及食管胃交界部(肿瘤与食管胃交界部的关系:肿瘤完全位于食管,未累及食管胃交界部;肿瘤中心位于远端食管,累及食管胃交界部;肿瘤中心位于食管胃交界部;肿瘤中心位于近端胃,累及食管胃交界部)。累及食管胃交界部者,记录肿瘤中心距食管胃交界部的距离:___cm (用于 Siewert 分型)。食管癌建议报与食管胃交界部的关系;食管胃交界部腺癌建议报 Siewert 分型。
4.3.5.4.2 (2)取材:
必要时涂碘(从固定液中取出并至少冲水半小时以上再做碘染色)识别病变(碘不染色区)。食管取材可自肿瘤中心从口侧切缘至肛侧切缘取一条组织分块包埋(包括肿瘤、肿瘤旁黏膜及两端切缘),并记录组织块对应的方位(宜附照片或示意图并做好标记)。推荐纵向取两端切缘与肿瘤的关系,对肿瘤距两端切缘较远者,也可横向取两端切缘。单独送检的闭合器切缘应剔除闭合器后全部取材观察。对肿瘤侵犯最深处及可疑环周切缘受累处应重点取材。推荐使用墨汁或碳素墨水标记环周切缘。对早期食管癌或新辅助治疗后病变不明显的根治术标本,建议将可疑病变区和瘤床全部取材。对周围黏膜糜烂、粗糙或碘不染色等改变的区域或周围食管/胃壁内结节及食管胃交界部组织应分别取材。送检的分组淋巴结应全部包埋取材。若附纵隔胸膜、肺和膈肌等其他邻近器官应观察取材。推荐取材组织大小不大于 2.0cm×1.5cm×0.3cm。标准的二野或三野清扫且未经新辅助治疗的根治术标本应检出 15 枚以上淋巴结。
4.3.5.5 5.病理报告内容及指南
食管癌的病理报告应包括与患者治疗和预后相关的所有内容,如标本类型、肿瘤部位、大体分型、大小及数目、组织学类型、亚型及分级、浸润深度、脉管和神经侵犯、壁内转移、周围黏膜情况、淋巴结情况、环周及两端切缘情况等。推荐报告最后注明(y)pTNM分期。
(1)大体描写:包括标本类型、肿瘤部位、大体分型、大小(肿瘤大小应量出三维的尺寸)及数目。
(2)主体肿瘤:组织学类型、亚型及分级(见附录B)、浸润深度(包括黏膜固有层、黏膜肌层、黏膜下层、浅肌层、深肌层、纤维膜及周围组织或器官。对于黏膜下层浸润癌,如为内镜下切除标本,应测量黏膜下层浸润深度(μm),建议区分SM1-黏膜下层侵犯深度<200μm 和 SM2-黏膜下层侵犯深度>200μm;如为外科根治术标本,建议区分 SM1-黏膜下层上 1/3、SM2-黏膜下层中1/3 和SM3-黏膜下层下 1/3)、切缘(内镜下切除标本包括侧切缘和基底切缘;根治切除标本包括口侧、肛侧切缘及环周切缘)(切缘的情况要说明,包括:浸润癌或上皮内瘤变/异型增生或巴雷特食管或巴雷特食管伴上皮内瘤变/异型增生;建议注明距切缘的距离;根治切除标本建议采用0、<0.1cm 及≥0.1cm 注明距环周切缘的距离)、淋巴管/血管浸润(尤其是对于内镜下切除标本,如果怀疑有淋巴管/血管浸润,建议做免疫组化 CD31、D2-40 确定是否有淋巴管/血管浸润;EVG染色判断有无静脉侵犯)、神经侵犯、壁内转移。
(3)癌旁:上皮内瘤变/异型增生及程度、巴雷特食管,有无食管炎、胃炎及类型。
(4)淋巴结转移情况:转移淋巴结数/淋巴结总数。宜报转移癌侵及淋巴结被膜外的数目。
(5)病理退缩反应(新辅助治疗的病例),遵照美国病理学院(College of American Pathologists,CAP)标准,联合残存肿瘤细胞比例(可参考 Mandard、Becker、日本食管疾病学会食管肿瘤退缩分级标准),对新辅助治疗后标本进行病理学评估(附录H)。
(6)应报告合并的其他病变。
(7)对拟采用 PD-1 抑制剂治疗的食管鳞状细胞癌患者,推荐癌组织中评估 PD-L1 表达 CPS 评分。PD-L1(Dako22C3)检测试剂盒已经获批食管鳞状细胞癌适应证,作为帕博利珠单抗治疗的伴随诊断,以 CPS≥10 作为阳性标准。食管胃交界腺癌应做HER2 免疫组化检测及错配修复蛋白(MLH1、PMS2、MSH2、MSH6)免疫组化检测和/或 MSI 检测。
(8)备注报告内容包括重要的相关病史(如相关肿瘤史和新辅助治疗史)。
(9)(y)pTNM 分期。
4.3.6 (六)分期综合治疗模式。
以下采用的是 UICC/AJCC 分期(第8 版)。
1.0 期/癌前病变:低级别上皮内瘤变建议随访,亦可行内镜下射频消融治疗。高级别上皮内瘤变建议行内镜下切除(EMR/ESD/MBM等),亦可根据临床条件选择内镜下射频消融、冷冻治疗等方式,由于病变过长或累及 3/4 环周以上、ESD 术后可能导致顽固性狭窄者也可考虑外科治疗。
2.Ⅰ期:T1a 期首选内镜下黏膜切除或黏膜剥离术。如果由于病变过长或累及 3/4 环周以上、ESD 术后可能导致顽固性狭窄或有可疑淋巴结转移,建议行外科手术治疗。T1b 及以上Ⅰ期首选外科手术治疗。如心肺功能差或拒绝手术者,可行内镜下ESD加术后放化疗。完全性切除的Ⅰ期食管癌,术后一般不行辅助治疗。
3.Ⅱ期:食管鳞癌:cT2N0M0 期首选手术治疗,cT2N1M0及cT3 N0 M0 期推荐新辅助治疗联合手术治疗。食管腺癌:cT2N0M0期首选手术治疗,cT1 N1 M0 期推荐新辅助治疗联合手术治疗。如心肺功能差或拒绝手术者,可行根治性放化疗。术前新辅助治疗包括同期放化疗与化疗。
4.Ⅲ期:食管鳞癌或腺癌均推荐新辅助治疗联合手术治疗。如心肺功能差或拒绝手术者,可行根治性放化疗。对于不能手术的Ⅲ期患者,目前的标准治疗是同步放化疗。
5.ⅣA 期鳞癌或腺癌:T4a 期推荐新辅助治疗联合手术治疗;如心肺功能差或拒绝手术者,也可行根治性放化疗。T4b 期推荐根治性放化疗,或单纯化疗(侵犯椎体、气管、主动脉、心脏等重要脏器)。
6.ⅣB 期:主要以全身系统性治疗与姑息治疗为主。一般状况好者,推荐全身系统性药物治疗,必要时可联合局部治疗;一般状况不能耐受上述治疗者,以姑息和支持治疗为主要手段。治疗目的为延长生命,提高生活质量。姑息治疗主要包括内镜治疗(包括食管扩张、食管支架等治疗)、止痛对症治疗及营养支持治疗等。
4.3.7 (七)治疗指引图。
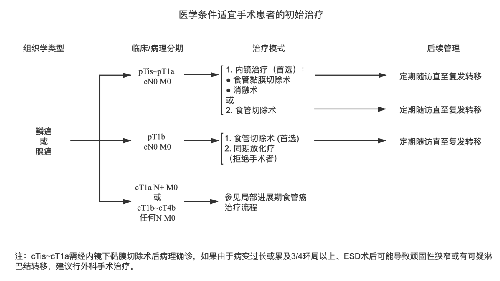


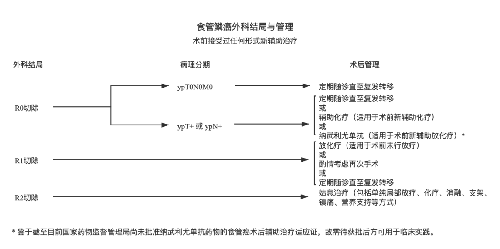
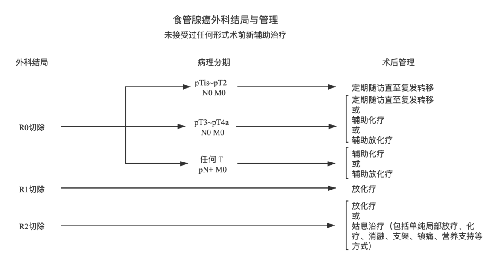
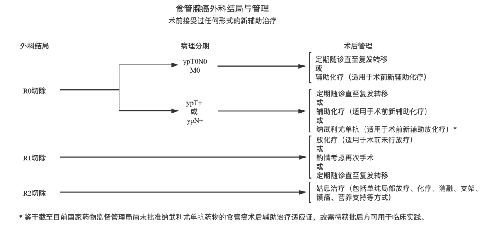
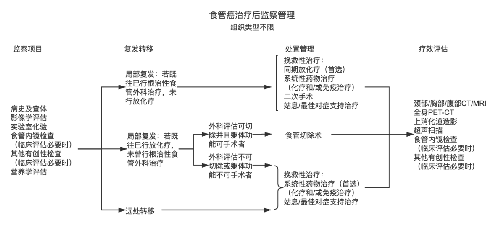
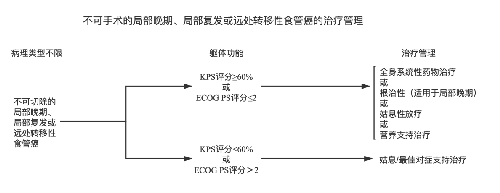
4.3.8 (八)营养支持。
对于有营养风险者,应及时制定营养支持计划。营养支持是指经肠内或肠外途径为不能正常进食的患者提供适宜营养素的方法,包括营养补充、营养支持、营养治疗三个部分,有口服营养补充、肠内营养及肠外营养三种方式。规范化的营养支持应包括营养支持的启动时机、途径选择、营养支持目标、营养素选择及监护计划等要素。食管癌外科手术涉及上消化道重建、胃酸分泌功能减弱或丧失,对于术后营养支持治疗有特殊要求。
4.3.8.1 1. 营养支持的指征
(2)BMI<18.5kg/m2;
(3)NRS2002≥5 分;
(4)SGA 评定为C 级。
4.3.8.2 2. 营养支持治疗的要求及途径
大多数有营养风险的食管癌患者通过强化膳食及口服营养补充进行营养支持即可。对 NRS2002 评分≥5 分或存在严重营养不良者,如经口途径不能满足目标量,可进行肠内营养-管饲、补充性肠外营养甚至全肠外营养,以改善患者治疗前营养状态及治疗后机体对应激的适应能力。
在制定肿瘤患者营养支持计划时,推荐采用间接测热法对肿瘤患者的能量消耗进行个体化测量以指导能量供给,使能量摄入量尽可能接近机体能量消耗值,以保持能量平衡,避免摄入过量或不足。若无法直接测量实际能量消耗值以指导营养供给,可采用体重公式计算法估算能量目标需要量,按照 25~30kcal/(kg·d)提供。推荐蛋白质补给量应>1.2 g/(kg·d),患者肾功能正常前提下可提高至2.0g/(kg·d)。
目前没有足够的证据显示何种手术方式在改善营养状态及营养管理方面的优势,手术方式的影响取决于术者的临床经验。术后营养支持治疗首选经胃肠道途径,可管饲和/或经口方式。对于术中留置营养管路的患者,术后 24 小时内即可开始肠内营养。肠内营养输注从低速开始,根据患者耐受情况适度递增至每日目标量。发生术后吻合口瘘者,需根据吻合口瘘严重程度、患者一般状态、营养需求综合考虑,制订个体化的营养支持方案。发生术后吻合口瘘,可考虑经任何途经的肠内管饲或联合肠外营养。
4.3.8.3 3. 出院后家庭营养支持治疗
食管癌患者出院后仍需要定期营养风险评估,持续存在严重营养不良者推荐营养支持。患者出院后营养支持首选膳食指导联合口服营养制剂,对于术中留置营养管的患者,出院时可以保留营养管,以备家庭肠内营养之需。家庭营养支持治疗需在经验丰富的营养支持小组(包括医师、营养师、药师及护士及等)指导监护下完成并且持续改进。
4.3.9 (九)姑息治疗。
姑息治疗,也称最佳对症支持治疗,是指以改善症状与生活质量为导向的多维度综合管理,尤其需要多学科协作共同制定治疗方案。
4.3.9.1 1. 进食困难
进食困难症状常源于上消化道不全梗阻,或者食管癌疾病本身导致的消化道动力障碍。目前国内尚缺乏标准化吞咽症状评估量表以指导临床。可考虑经鼻或胃/空肠造口置管进行暂时性管饲营养支持,若将来无根治性食管癌治疗计划,则经多学科讨论后也可考虑行食管支架置入。
4.3.9.2 2. 完全梗阻
上消化道完全梗阻患者的姑息治疗旨在维持患者每日营养摄入,基于创建上消化道旁路的胃/空肠造口置管作为首选方法,经验丰富的内镜中心可考虑食管内镜下球囊扩张,消融治疗后带膜支架置入,或联合放化疗。
4.3.9.3 3. 上消化道出血
一旦发生呕血、黑便等上消化道出血症状,则提示食管癌疾病已濒临终末期,原发性肿瘤破溃或继发性食管-主动脉瘘发生。可根据医疗条件及患者病情,酌情考虑选择内镜、介入、外科治疗等干预措施。严密监测血红蛋白水平,止血及抑酸性药物干预,预防重度贫血、失血性休克发生。
4.4 附录 A 早期/表浅食管癌推荐巴黎分型(同早期/表浅食管癌日本大体分型,即 0 型):
1.隆起型(0-Ⅰ):又可分为有蒂隆起型(0-Ⅰp)和无蒂隆起型(0-Ⅰs)。
2.浅表型(0-Ⅱ):又可分为表浅隆起型(0-Ⅱa)、表浅平坦型(0-Ⅱb)和表浅凹陷型(0-Ⅱc),同时具有表浅隆起和表浅凹陷的病灶根据表浅隆起/表浅凹陷的比例分为表浅凹陷+表浅隆起型(0-Ⅱc+Ⅱa 型)和表浅隆起+表浅凹陷型(0-Ⅱa+Ⅱc 型)。
3.凹陷(溃疡)型(0-Ⅲ):凹陷和表浅凹陷结合的病灶根据凹陷/表浅凹陷的比例分为表浅凹陷+凹陷型(0-Ⅱc+Ⅲ型)和凹陷+表浅凹陷型(0-Ⅲ+Ⅱc 型)。
4.5 附录 B 食管癌 WHO 组织学类型(参照 2019 版消化系统肿瘤WHO分类)
4.6 附录 C 食管癌 TNM 分期(2017 年第8 版UICC/AJCC)
食管癌分期中 T、N、M 的定义
4.6.1.1 原发肿瘤(T)
TX 原发肿瘤不能评价
T0 没有原发肿瘤的证据
Tis 高级别上皮内瘤变/异型增生
T1 肿瘤侵及黏膜固有层、黏膜肌层或黏膜下层
T1a 肿瘤侵及黏膜固有层或黏膜肌层
T1b 肿瘤侵及黏膜下层
T2 肿瘤侵及固有肌层
4.6.1.2 区域淋巴结(N)
NX 区域淋巴结不能评价
4.6.1.3 远处转移(M)
M0 无远处转移
M1 有远处转移
4.6.2 临床分期(cTNM)预后分组:
| 临床分期 | c T N M |
| 鳞癌 | |
| 0 | TisN0 M0 |
| Ⅰ | T1 N0~1 M0 |
| Ⅱ | T2 N0~1 M0 T3 N0 M0 |
| Ⅲ | T3 N1 M0 T1~3 N2 M0 |
| ⅣA | T4 N0~2 M 任何 T N3 M00 |
| ⅣB | 任何 T 任何N M1 |
| 腺癌 | |
| 0 | TisN0 M0 |
| Ⅰ | T1 N0 M0 |
| ⅡA | T1 N1 M0 |
| ⅡB | T2 N0 M0 |
| Ⅲ | T2 N1 M0 T3~4a N0~1 M0 |
| ⅣA | T1~4a N2 M0 T4b N0~2 M0 任何 T N3 M0 |
| ⅣB | 任何 T 任何N M1 |
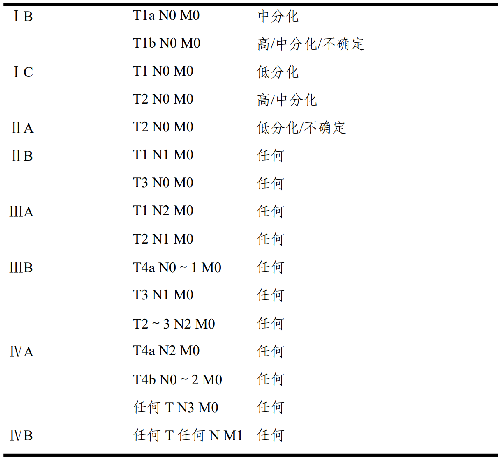
4.6.3 病理分期(pTNM)预后分组:
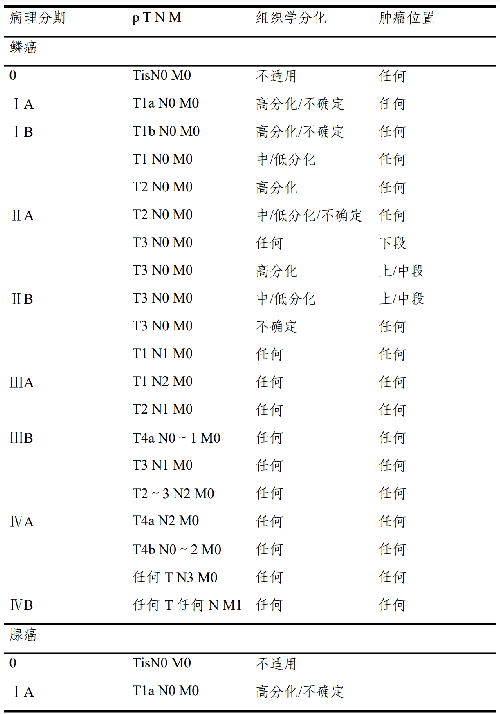
注释:
1.要达到准确分期,区域淋巴结的数目应该≥15 个。
2.肿瘤部位按照肿瘤中心的位置分段(分上、中、下段,上段=颈段+胸上段,中段=胸中段;下段=胸下段+腹段)。
3.若肿瘤累及食管胃交界部,肿瘤中心在食管胃交界部食管侧者或在胃侧 2cm 之内者(Siewert I 型及 II 型),按食管癌分期;肿瘤中心在近端胃 2cm 之外(Siewert III 型)按胃癌分期。肿瘤中心虽在近端胃 2cm 之内但未累及食管胃交界部者,按胃癌分期。
4.基底细胞样鳞状细胞癌、梭形细胞鳞状细胞癌、小细胞癌、大细胞神经内分泌癌及未分化癌按低分化鳞状细胞癌分期。混合有鳞状细胞癌成分的混合型癌(如腺鳞癌)或组织学类型不明确的按鳞状细胞癌分期。
5.食管的神经内分泌瘤(NET)十分罕见,其分期参照胃肠道神经内分泌瘤的 TNM 分期。
6.本分期不适用于非上皮性肿瘤,如淋巴瘤、肉瘤、胃肠道间质瘤和黑色素瘤等。
7.目前国际上有两大食管癌 TNM 分期系统。西方主导的UICC/AJCC分期认为锁骨上淋巴结转移属于 M1,腹腔干淋巴结仍然属于区域淋巴结。日本食道学会(JES)则认为锁骨上淋巴结仍然是胸段食管癌的区域淋巴结,而腹腔干淋巴结不是胸上段食管癌的区域淋巴结。
新辅助治疗后病理分期(ypTNM)预后分组:
| 新辅助治疗后病理分期 | yp T N M |
| Ⅰ | T0~2 N0 M0 |
| Ⅱ | T3 N0 M0 |
| ⅢA | T0~2 N1 M0 |
| ⅢB | T4a N0 M T3 N1~2 M00 T0~3 N2 M0 |
| ⅣA | T4a N1~2,X M0 T4b N0~2 M0 任何 T N3 M0 |
| ⅣB | 任何 T 任何N M1 |
4.7 附录 D 营养风险筛查 2002
4.7.1 A. 营养状态受损评分(取最高分)
| 0 分 | 正常营养状态 |
| 1 分(任一项) | 近3个月体质量下降>5 近1周内进食量减少 25%~50%% |
| 2 分(任一项) | 近2个月体质量下降>5% 近1周内进食量减少 50%~75% |
| 3 分(任一项) | 近1个月体质量下降>5% 近1周内进食量减少>75% 体质量指数<18.5kg/m2 伴有一般情况差 |
B. 疾病严重程度评分(营养需求的增加)(取最高分)
| 0 分 | 正常营养需求 |
| 1 分(任一项) | 一般恶性肿瘤、髋部骨折、长期血液透析、糖尿病、慢性疾病(如肝硬化、慢性阻塞性肺病) |
| 2 分(任一项) | 血液恶性肿瘤、重症肺炎、腹部大手术、脑卒中 |
| 3 分(任一项) | 重症头部损伤、骨髓移植、重症患者APACHEⅡ评分>10 分的 ICU 患者 |
年龄评分
| 1 分 | 年龄≥70 岁 |
总分(A+B+C)
注:APACHE II 为急性生理学与慢性状况评分系统II。
4.8 附录 E 全球(营养)领导人发起的营养不良诊断标准
4.8.1 A. 表现型指标
| 体质量下降 | 过去6个月>5% 或超过6个月>10% |
| 低体质量指数 | <70 岁:<20 kg/m2,<18.5 kg/m2(亚洲人) ≥70 岁:<22 kg/m2,<20 kg/m2(亚洲人) |
| 肌肉量减少 | 通过经验证的测量方法得到肌肉减少结果 |
B. 病因学指标
4.9 附录 F 放射治疗及化学治疗疗效判定标准
4.9.1 1.WHO 实体瘤疗效评价标准:
完全缓解,肿瘤完全消失超过 1 个月。
部分缓解,肿瘤最大直径及最大垂直直径的乘积缩小达50%,其他病变无增大,持续超过 1 个月。
病变稳定,病变两径乘积缩小不超过 50%,增大不超过25%,持续超过1个月。病变进展,病变两径乘积增大超过 25%。
4.9.2 2.RECIST 疗效评价标准:
4.9.2.1 2.1 靶病灶的评价
完全缓解,所有靶病灶消失。
部分缓解,靶病灶最长径之和与基线状态比较,至少减少30%。病变进展,靶病灶最长径之和与治疗开始之后所记录到的最小的靶病灶最长径之和比较,增加 20%,或者出现一个或多个新病灶。病变稳定,介于部分缓解和疾病进展之间。
4.9.2.2 2.2 非靶病灶的评价
完全缓解,所有非靶病灶消失和肿瘤标志物恢复正常。未完全缓解/稳定,存在 1 个或多个非靶病灶和/或肿瘤标志物持续高于正常值。病变进展,出现 1 个或多个新病灶和/或已有的非靶病灶明确进展。
4.9.3 3.最佳总疗效的评价
最佳总疗效的评价是指从治疗开始到疾病进展或复发之间所测量到的最小值。通常,患者最好疗效的分类由病灶测量和确认组成。
4.10 附录 G 患者状况评分
4.10.1 1. Karnofsky 评分(KPS,百分法)
100 正常,无症状和体征,无疾病证据
70 生活可自理,但不能维持正常生活或工作
60 生活能大部分自理,但偶尔需要别人帮助,不能从事正常工作
40 生活不能自理,需要特别照顾和治疗
30 生活严重不能自理,有住院指征,尚不到病重
10 重危,临近死亡
0 死亡
4.10.2 2. Zubrod-ECOG-WHO 评分(ZPS,5 分法)
0 正常活动
1 症轻状,生活自理,能从事轻体力活动2 能耐受肿瘤的症状,生活自理,但白天卧床时间不超过50%3 肿瘤症状严重,白天卧床时间超过 50%,但还能起床站立,部分生活自理
4 病重卧床不起
5 死亡
4.11 附录 H 新辅助治疗后病理学评估:
注释:
2)疗效评估根据存活肿瘤细胞决定,经过新辅助治疗后出现的无肿瘤细胞的角化物或黏液湖不能认为是肿瘤残留;淋巴结内出现无肿瘤细胞的角化物或黏液湖不能认为是肿瘤转移。
4.12 附录 I 术语和定义(适用本指南)
4.12.1 (一)食管癌
从下咽食管起始部到食管胃结合部之间食管上皮来源的癌。包括食管鳞癌与食管腺癌两种主要类型及其他少见类型恶性肿瘤。
4.12.1.1 1.食管鳞状细胞癌
4.12.1.2 2.食管腺癌
主要起源于食管下 1/3 的巴雷特黏膜的腺样分化的恶性上皮细胞肿瘤,偶尔起源于上段食管的异位胃黏膜,或食管固有腺体。
4.12.2 (二)巴雷特食管
指食管下段的复层鳞状上皮被单层柱状上皮所代替。
4.12.3 (三)食管的癌前疾病和癌前病变
癌前疾病包括慢性食管炎、巴雷特食管炎、食管白斑症、食管憩室、贲门失弛缓症、食管管型、返流性食管炎和食管良性狭窄。癌前病变是指以食管黏膜鳞状上皮内不同层次的异型鳞状细胞为特征的癌前病变,根据病变累及层次,分为低级别上皮内瘤变/异型增生(局限于鳞状上皮下 1/2),高级别上皮内瘤变/异型增生(累及食管鳞状上皮超过下 1/2,既往称原位癌)。
4.13 附录 J 缩略语(适用本指南)
PET-CT:正电子发射计算机体层成像(PositronEmissionTomography-Computed Tomography,PET-CT)
IPCL:食管上皮乳头内毛细血管袢(Intrapapillary CapillaryLoops)
CLE:激光共聚焦显微内镜(Confocal Laser Endomicroscopy)
EUS:超声内镜(Endoscopic Ultrasonography)
EBUS:超声支气管镜(endobronchial ultrasound,EBUS)
UICC:国际抗癌联盟(Union for International Cancer Control)
AJCC:美国癌症联合会(American Joint Committee on Cancer)
JES:日本食道学会(Japan Esophageal Society)
NRS2002:营养风险筛查 2002(Nutritional Risk Screening 2002)
SGA:主观全面评定(Subjective Global Assessment)
PG-SGA:患者参与的主观全面评定(Patient GeneratedSubjectiveGlobal Assessment)
GTV:肿瘤靶区(Gross Tumor Volume)
GTVnd:淋巴结靶区(Gross Tumor Volume LymphNode)
CTV:临床靶区(Clinical Target Volume)
PTV:计划靶区(Planning Target Volume)
AUC:浓度-时间曲线下面积(Area Under The Concentration-TimeCurve)
CAP:美国病理学院(College of American Pathologists)
CPS:联合阳性评分(Combined Positivity Score)
EMR:内镜下黏膜切除术(Endoscopic Mucosal Resection)
MBM:多环套扎黏膜切除术(multi-band mucosectomy)
ESD:内镜下黏膜剥离术(Endoscopic Submucosal Dissection)
RFA:射频消融术(Radiofrequency Ablation)
PDT:光动力疗法(Photodynamic Therapy)
APC:氩离子凝固术(Argon Plasma Coagulation)
5 附件 食管癌诊疗指南(2022 年版)编写审定专家组(按姓氏笔画排序)
组长:王绿化
副组长:于金明、于振涛、李印
成员:王军、王贵齐、王峰、王镇、王鑫、刘俊峰、孙永琨、李志刚、李勇、陈克能、赵心明、柳硕岩、姜宏景、秦建军、黄镜、康晓征、韩泳涛、惠周光、傅剑华、谭黎杰、薛丽燕