2 英文参考
oxaliplatin[湘雅医学专业词典]
3 奥沙利铂药典标准
3.1 品名
3.1.1 中文名
3.1.2 汉语拼音
Aoshalibo
3.1.3 英文名
Oxaliplatin
3.2 结构式
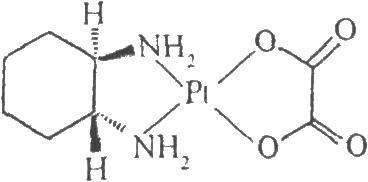
3.3 分子式与分子量
C8H14N2O4Pt 397.29
3.4 来源(名称)、含量(效价)
本品为(1R-反式)-(1,2-环己二胺-N,N')[草酸(2-)-O,O']合铂。按干燥品计算,含C8H14N2O4Pt应为98.0%~102.0%。
3.5 性状
本品为白色或类白色结晶性粉末;无臭。
3.5.1 比旋度
取本品适量,精密称定,加水溶解并定量稀释制成每1ml中含5mg的溶液,依法测定(2010年版药典二部附录Ⅵ E),比旋度为+74.5°至+78.0°。
3.6 鉴别
(1)取本品20mg,加水5ml溶解,加硫脲少许,加热,溶液即显黄色。
(2)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(3)本品的红外光吸收图谱应与对照的图谱(《药品红外光谱集》1209图)一致。
3.7 检查
3.7.1 酸度
取本品20mg,加水10ml溶解后,依法测定(2010年版药典二部附录Ⅵ H),pH值应为5.0~7.0。
3.7.2 溶液的澄清度与颜色
取本品20mg,加水10ml溶解后,溶液应澄清无色。
3.7.3 草酸
取本品,精密称定,加水适量,强烈振摇并短时超声使溶解,用水稀释制成每1ml中含2mg的溶液,作为供试品溶液(临用新配);另精密称取草酸对照品14mg,置250ml量瓶中,用水溶解并稀释至刻度,摇匀,作为对照品溶液(1);精密量取对照品溶液(1) 5ml,置100ml量瓶中用水稀释至刻度,摇匀,作为对照品溶液(2);取硝酸钠12.5mg,置250ml量瓶中,加水溶解并稀释至刻度,摇匀,再精密量取2ml与对照品溶液(1)25ml,置100ml量瓶中,用水稀释至刻度,摇匀,作为系统适用性试验溶液。照高效液相色谱法(2010年版药典二部附录Ⅴ D)试验,用十八烷基硅烷键合硅胶为填充剂;以缓冲液[取氢氧化四丁基铵溶液(320g→1000ml)10ml与磷酸二氢钾1.36g,加水使溶解并稀释至1000ml,摇匀,用磷酸调节pH值至6.0)]-乙腈(80:20)为流动相;检测波长为205nm。取对照品溶液(2)与系统适用性试验溶液各20μl,分别注入液相色谱仪,记录色谱图,对照品溶液(2)的色谱图中草酸峰的信噪比应不小于20,系统适用性试验溶液的色谱图中硝酸峰与草酸峰的分离度应大于9.0。再精密量取供试品溶液与对照品溶液(2)各20μl,分别注入液相色谱仪,记录色谱图,供试品溶液色谱图中如有与对照品溶液(2)主峰保留时间一致的杂质峰,其峰面积不得大于对照品溶液(2)的主峰面积(0.1%)。
3.7.4 二水合二氨基环己烷铂(杂质Ⅰ)
取本品适量,精密称定,加水适量,强烈振摇并短时超声使溶解,放冷,用水稀释制成每1ml中含奥沙利铂2mg的溶液,作为供试品溶液(临用新配);另精密称取杂质Ⅰ二硝酸盐对照品12.5mg,置250ml量瓶中,加甲醇63ml,超声使溶解,用水溶解并稀释至刻度,摇匀,作为对照品溶液(1);精密量取对照品溶液(1) 3ml,置200ml量瓶中,用水稀释至刻度,摇匀,作为对照品溶液(2);取对照品溶液(1),用0.2mg/ml氢氧化钠溶液调节pH值至6.0,于70℃加热4小时,放冷,作为系统适用性试验溶液。照高效液相色谱法(2010年版药典二部附录Ⅴ D)试验,用十八烷基硅烷键合硅胶为填充剂;以庚烷磺酸钠溶液(取庚烷磺酸钠1g和磷酸二氢钾1.36g,加水溶解,并稀释至1000ml,用磷酸调节pH值至3.0±0.05)-乙腈(80:20)为流动相I检测波长为215nm;流速为每分钟2ml;柱温为40℃。取对照品溶液(2)与系统适用性试验溶液各20μl,分别注入液相色谱仪,记录色谱图。对照品溶液(2)的色谱图中杂质Ⅰ峰的信噪比不小于10,系统适用性试验溶液的色谱图中二水合二氨基环己烷铂二聚体(杂质Ⅱ)峰(保留时间约为6.4分钟)与杂质Ⅰ峰(保留时间约为4.3分钟)的分离度应不得小于7.0。再精密量取供试品溶液和对照品溶液(2)各20μl,分别注入液相色谱仪,记录色谱图至杂质Ⅰ保留时间的2.5倍,供试品溶液色谱图中如有与对照品溶液(2)主峰保留时间一致的杂质峰,峰面积不得大于对照品溶液(2)主峰面积的3.3倍(0.1%)。
3.7.5 双羟基奥沙利铂(杂质Ⅲ)及其他杂质
取本品,精密称定,加水适量,强烈振摇并短时超声使溶解,用水稀释制成每1ml中含2mg的溶液,作为供试品溶液(临用新配);精密量取适量,用水定量稀释制成每1ml中含2μg的溶液,作为对照溶液。照含量测定项下的色谱条件,取对照溶液10μl,注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高约为满量程的5%。再精密量取供试品溶液与对照溶液各10μl,分别注入液相色谱仪,记录色谱图至主峰保留时间的3倍。供试品溶液色谱图中除草酸峰外,如有与含量测定项下的系统适用性试验溶液第二个主峰保留时间一致的色谱峰(杂质Ⅲ峰),其峰面积不得大于对照溶液主峰面积的4.6倍(0.1%);其他单个杂质峰面积不得大于对照溶液的主峰面积(0.1%),其他杂质峰面积的总和不得大于对照溶液主峰面积(0.1%)。
3.7.6 左旋异构体
取本品,加甲醇溶解并稀释制成每1ml中含0.6mg的溶液,作为供试品溶液;精密量取适量,加甲醇定量稀释制成每1ml中含奥沙利铂1.2μg的溶液,作为对照溶液;另精密称取奥沙利铂左旋异构体适量,加甲醇制成每1ml中含奥沙利铂左旋异构体1,2μg的溶液作为对照品溶液。取供试品溶液和对照品溶液等量混合,作为系统适用性试验溶液。照高效液相色谱法(2010年版药典二部附录Ⅴ D)试验,用甲氨酸酯纤维素衍生化合物吸附硅胶为填充剂(CHIRALCELOC)(色谱柱规格:250mm×4.6mm,5μm);以甲醇-乙醇(70:30)为流动相;检测波长为254nm。取系统适用性溶液20μl注入液相色谱仪,记录色谱图,理论板数按奥沙利铂峰计算不低于2000,奥沙利铂峰与奥沙利铂左旋异构体峰之间的分离度应符合要求。取对照溶液20μl注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高约为满量程的20%。再精密量取供试品溶液、对照溶液及对照品溶液各20μl,分别注入液相色谱仪,记录色谱图,供试品溶液色谱图中如有与对照品溶液主峰保留时间一致的杂质峰,其峰面积不得大于对照溶液主峰面积的0.5倍(0.1%)。
3.7.7 银
取本品0.1g,精密称定,置25ml量瓶中,用2%硝酸溶液溶解并稀释至刻度,摇匀,作为供试品溶液(如有必要,调整稀释倍数至适宜浓度);精密量取银单元素标准溶液适量,用2%硝酸溶液制成每1ml分别含银1、2、3、4、5ng的溶液,作为系统标准溶液。取上述系列标准溶液与供试品溶液,照原子吸收分光光度法(2010年版药典二部附录Ⅳ D 第一法),使用原子吸收石墨炉在328.1nm的波长处测定,计算。本品含银不得过0.0005%。
3.7.8 干燥失重
取本品约0.2g,在105℃干燥至恒重,减失重量不得过0.5%(2010年版药典二部附录Ⅷ L)。
3.8 含量测定
照高效液相色谱法(2010年版药典二部附录Ⅴ D)测定。
3.8.1 色谱条件与系统适用性试验
用十八烷基硅烷键合硅胶为填充剂;以磷酸溶液(取10%磷酸溶液0.6ml,加水稀释成1000ml,用氢氧化钠溶液或磷酸调节pH值至3.0)-乙腈(99:1)为流动相;检测波长为210nm。取本品约10mg,加过氧化氢试液2ml使溶解,加水稀释至10ml,摇匀,作为系统适用性试验溶液,立即量取10μl注入液相色谱仪,记录色谱图,三个主峰依次为过氧化氢溶剂峰、杂质Ⅲ峰与奥沙利铂峰,杂质Ⅲ峰与奥沙利铂峰之间的分离度应大于10.0。
3.8.2 测定法
取本品10mg,精密称定,置100ml量瓶中,加水溶解并稀释至刻度,摇匀,作为供试品溶液,精密量取20μl注入液相色谱仪,记录色谱图;另取奥沙利铂对照品,同法测定。按外标法以峰面积计算,即得。
3.9 类别
抗肿瘤药。
3.10 贮藏
3.11 制剂
3.12 附:


3.13 版本
《中华人民共和国药典》2010年版 第一增补本
4 奥沙利铂介绍
4.1 别名
4.2 外文名
Oxaliplatin for Injection
4.3 性状
奥沙利铂为白色或类白色冻干疏松块状物或粉末. 分子式:C8H14N2O4Pt,分子量:397.29
4.4 奥沙利铂的药理毒理
奥沙利铂出现铂类化合物的一般毒性反应。出现种属特异的心脏毒性。奥沙利铂未出现顺铂的肾脏毒性,亦无卡铂的骨髓毒性。奥沙利铂属于新的铂类衍生物,本品通过产生烷化结合物作用于DNA,形成链内和链间交联,从而抑制DNA的合成及复制。奥沙利铂与DNA结合迅速,最多需15分钟,而顺铂与DNA的结合分为两个时相,其中包括一个48小时后的延迟相。在人体内给药一小时之后,通过测定白细胞的加合物,可显示其存在。复制过程中的DNA合成,其后DNA的分离、RNA及细胞蛋白质的合成均被抑制,某些对顺铂耐药的细胞系,奥沙利铂治疗有效。
4.5 奥沙利铂的药代动力学
以130mg/m2的剂量连续滴注2小时,其血浆总铂达峰值5.1±0.8mg/ml/h,模拟的曲线下面积为189±45mg/ml/h。当输液结束时,50%的铂与红细胞结合,而另外50%存在于血浆中。25%的血浆铂呈游离态,另外75%血浆铂与蛋白质结合。蛋白质结合铂逐步升高,于给药第五天后稳定于95%的水平。药物的清除分为两个时相,其清除相半衰期约为40小时。多达50%的药物在给药48小时之内由尿排出(55%的药物在6天之后清除)。由粪便排出的药量有限(给药11天后仅有5%经粪便排出)。在肾功能衰竭的病人中,仅有可过滤性铂的清除减少,而并不伴有毒性的增加,因此并不需要调整用药剂量。
与红细胞结合的铂清除很慢。在给药后的第22天,红细胞结合铂的水平为血浆峰值的56%,而此时大多数的总血浆铂已被清除。在以后的用药周期中,总的或不被离心的血浆铂水平并无显著升高;而红细胞结合铂出现明显的早期累积现象。
4.6 奥沙利铂的适应症
用于经氟脲嘧啶治疗失败后的结直肠癌转移的患者,可单独或联合氟尿嘧啶使用。
4.7 奥沙利铂的用法用量
在单独或联合用药时,推荐剂量为按体表面积一次130mg/m2,加入250~500ml5%葡萄糖溶液中输注2-6小时。没有主要毒性出现时,每3周(21天)给药1次。调整剂量以安全性,尤其是神经学的安全性为依据。
4.8 奥沙利铂的禁忌症
4.9 奥沙利铂的不良反应
1、造血系统:本品具有一定的血液毒性。当单独用药时,可引起下述不良反应:贫血、白细胞减少、粒细胞减少、血小板减少,有时可达3级或4级。当与5-氟脲嘧啶联合应用时,中性粒细胞减少症及血小板减少症等血液学毒性增加;
2、消化系统:单独应用本品,可引起恶心、呕吐、腹泻。这些症状有时很严重。当与5-氟脲嘧啶联合应用时,这些副作用显著增加。建议给予预防性和/或治疗性的止吐用药;
3、神经系统:以末梢神经炎为特征的周围性感觉神经病变。有时可伴有口腔周围、上呼吸道和上消化道的痉挛及感觉障碍。甚至类似于喉痉挛的临床表现而无解剖学依据。可自行恢复而无后遗症。这些症状常因感冒而激发或加重。感觉异常可在治疗休息期减轻,但在累积剂量大于800mg/m2(6个周期)时,有可能导致永久性感觉异常和功能障碍。在治疗终止后数月之内,3/4以上病人的神经毒性可减轻或消失。当出现可逆性的感觉异常时,并不需要调整下一次本品的给药剂量。给药剂量的调整应以所观察到的神经症状的持续时间和严重性为依据。当感觉异常在两个疗程中间持续存在,疼痛性感觉异常和/或功能障碍开始出现时,本品给药量应减少25%(或100mg/m2),如果在调整剂量之后症状仍持续存在或加重,应停止治疗。在症状完全或部分消失之后,仍有可能全量或减量使用,应根据医师的判断做出决定。
4.10 注意事项
1奥沙利铂应在具有抗癌化疗经验的医师的监督下使用。特别是与具有潜在性神经毒性的药物联合用药时,应严密监测其神经学安全性;
2、由于奥沙利铂在消化系统毒性,如恶心、呕吐,应给予预防性或治疗性的止吐用药;
3、当出现血液毒性时(白细胞<2000/mm3或血小板<50000/mm3〉,应推迟下一周期用药,直到恢复;
4、在每次治疗之前应进行血液学计数和分类,亦应进行神经学检查,之后应定期进行。
4.11 孕妇及哺乳期妇女用药
对胎儿可能有毒性。奥沙利铂在孕期禁用。通过乳汁排泄的研究尚未进行,禁用于哺乳期。
4.12 药物相互作用
因与氯化钠和碱性溶液(特别是5-氟脲嘧啶)之间存在配伍禁忌,本品不要与上述制剂混合或通过同一条静脉同时给药。体外研究显示,在红霉素、水杨酸盐、紫杉醇和丙戊酸钠等化合物存在的情况下,本品的蛋白结合无明显变化。在动物和人的体内研究中显示,与5-氟脲嘧啶联合应用具有协同作用。
4.13 规格
冻干粉:50mg, 100mg/瓶.