3 基本信息
ICS 11.020
C 50
中华人民共和国卫生行业标准WS/T 224—2018《真空采血管的性能验证》(Performance verification of vacuum tubes for venous blood specimen)由中华人民共和国国家健康委员会于2018年04月27日《关于发布〈真空采血管的性能验证〉等4项推荐性卫生行业标准的通告》(国卫通〔2018〕7号)发布,自2018年11月01日起实施。本标准代替 WS/T 224—2002。
4 发布通知
关于发布《真空采血管的性能验证》等4项推荐性卫生行业标准的通告
国卫通〔2018〕7号
现发布《真空采血管的性能验证》等4项推荐性卫生行业标准,编号和名称如下:
WS/T 224—2018 真空采血管的性能验证(代替WS/T 224—2002)
WS/T 404.4—2018 临床常用生化检验项目参考区间 第4部分:血清总胆红素、直接胆红素
WS/T 573—2018 感染性疾病免疫测定程序及结果报告
上述标准自2018年11月1日起施行。
特此通告。
国家卫生健康委员会
2018年4月27日
5 前言
本标准按照GB/T 1.1-2009给出的规则起草。
本标准代替WS/T 224-2002《真空采血管及其添加剂》。
与WS/T 224-2002相比,除编辑性修改外主要变化如下:
——增加了真空采血管的临床评价指标(见4.4~4.6和4.8);
——删除了原标准中部分由生产厂商测试的内容(2002年版4~7和9-13);
——修改了管体强度标准,将相对离心力提高到3000g(见4.3,2002年版8.1)。
本标准起草单位:广东省人民医院、中山大学孙逸仙纪念医院、广州医科大学附属第一医院、同济大学附属同济医院。
本标准主要起草人:邹伟民、李红玉、林勇平、万海英、邓冠华。
6 标准正文
6.1 1 范围
本标准适用于临床实验室在正式使用新采血管前对其进行性能验证。对正在使用的采血管的检测结果有疑问、查找原因可能与采血管相关时,也可采用本标准对采血管进行性能验证。
6.2 2 规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
6.3 3 术语和定义
下列术语和定义适用于本文件。
3.1
添加剂 additive
在一个标本采集管中,添加的任何促进一个预定功能(如防止凝血或糖酵解)的试剂。
注:尽管容器盖不被认为是一种添加剂,但它可能含有或涂覆添加剂,若它们进入标本中接触,应被认为是添加剂。
3.2
促凝剂 clot activator
用于激发凝血机制的试剂。
3.3
抗凝剂 anticoagulant
3.4
偏倚 bias
3.5
管盖 tube closure
密闭容器的组件。
注:管盖的作用使采血后容器的口部与外界形成隔离以确保安全,一般管盖内部还有一个能与容器口部形成密封的塞体以保护血样,本标准称其为管盖而不称其为塞子,目的是突出其安全作用。
3.6
公称液体容量 nominal liquid capacity,NLC
3.7
重量测定分析法 gravimetric analysis
通过称重和校正液体的质量密度测定液体体积的方法。
注:本文件中,以1000mL水的质量为1000g。
3.8
抽吸量 draw volume,DV
注:在标准条件(温度18℃~25℃,标准大气压)下,真空采血管采水到平衡时的总重量。
3.9
真空采血管 vacuum tube
3.10
采血管附加物 receptacle accessory
示例:放入血清或血浆采血管中的小型塑料惰性球(或分离胶),用于离心后从血液中分离血清或血浆。
3.11
样本 sample
研究中实际观测或调查的一部分个体。通过检查、研究和分析样本的特征来反映总体情况。
3.12
验证 verification
通过提供客观证据对规定要求已得满足的认定。
6.4 4 真空采血管的性能验证
6.4.1 4.1 外观
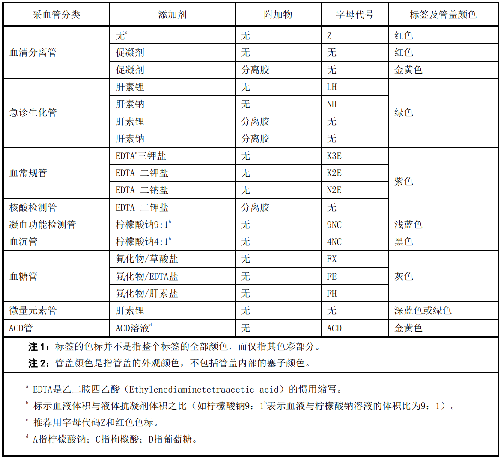
试管应透明,无异物;试管无变形和破损;标识应清晰(真空采血管标签及管盖颜色国际通用标准参见附录A);管盖无脱落;采血管内的分离胶的胶体应呈凝胶状。
6.4.2 4.2 抽吸量
6.4.2.1 4.2.1 要求
抽吸量应准确,抽吸量与公称液体容量的相对偏倚应在-10%~10%之间。
6.4.2.2 4.2.2 验证方法
6.4.2.2.1 4.2.2.1 试剂
水,符合GB/T 6682的三级水的要求,温度在18℃~25℃。
6.4.2.2.2 4.2.2.2 仪器
500mL烧杯;考察管;滤纸;分析天平;20G(内径38mm)标准双向软连接采血针。
6.4.2.2.3 4.2.2.3 取样
采用一次抽样方案取样,随机抽取30支,按照标准操作进行采水,记录相关数据。
6.4.2.2.4 4.2.2.4 步骤(重量测定分析法)
a) 将 500mL 的烧杯装满水;
b) 将 1~30 支管进行编号且称重,这为采血管的初始重量,记为 Wi1,其中 i 为 1~30;
c) 将采血针的静脉穿刺针(穿透一个纯胶塞)浸入盛满水的烧杯中,另一端的管塞穿刺针刺穿真空采血管的胶塞进行采水,保持采血管的高度与水液面的高度大致一致,采水达到平衡时拔管;
d) 依次将编号为 1~30 的采血管进行采水,注意烧杯内水的液面高度与采血管的液面高度保持在同一水平线上;
e) 采水完毕,用滤纸吸取胶塞表面可能残留的水分;
f) 然后将采水后编号为 1~30 的采血管进行称重,这是真空采血管采水后的重量,记为 Wi2,其中 i 为 1~30;
g) 抽吸量的计算见式(1):

式中:
Wi1----采血管的初始重量,单位为克(g);
Wi2----采血管采水后的重量,单位为克(g);
i ----自然数编号,范围为1~30;
DV----抽吸量,单位为克(g);
N ----检测对象的总量,即 N=30。
注:本标准中,以 1000mL 水的质量为 1000g。
h) 抽吸量与公称液体容量之间的相对偏差(relative deviation,简写为 RD),其计算见式(2):
RD=(DV-NLC)/NLC×100% ................................. (2)
式中:
RD ----相对偏差;
DV ----抽吸量,单位为克(g);
NLC----公称液体容量,单位为毫升(mL)。
6.4.3 4.3 管体强度
6.4.3.1 4.3.1 要求
采血管在水平式离心机下应能承受 3000g 的相对离心力,即测试采血管在充装水至刻度线的条件下,用水平式离心机采用 3000g 的相对离心力,离心 10min 而不发生破裂或泄露。
6.4.3.2 4.3.2 验证方法
6.4.3.2.1 4.3.2.1 试剂
水,符合GB/T 6682的三级水的要求,温度在18℃~25℃。
6.4.3.2.2 4.3.2.2 仪器
500mL烧杯;水平离心机,最大能提供5000g相对离心力。
6.4.3.2.3 4.3.2.3 步骤
a) 随机抽取 30 支采血管充装水至刻度线,并保持采血管外观干净,无液体;
b) 将 30 支采血管放入水平离心机中,注意离心机的平衡;
c) 设置离心参数,当转速稳定时的最大相对离心力为 3000g,离心时间为 10min(例:离心半径为 17cm,转速为 4000r/min,离心 10min);
6.4.4 4.4 血清分离管纤维蛋白挂壁
6.4.4.1 4.4.1 要求
按照 4.4.2.2 的步骤进行测试,血清分离管离心后不应出现纤维蛋白挂壁。
注:若采用分离胶促凝管进行测试时,可以增加评估分离胶的性能。
6.4.4.2 4.4.2 验证方法
6.4.4.2.1 4.4.2.1 仪器
考察管;采血针;医用消毒用具;40 个静脉血标本;水平离心机;试管架。
6.4.4.2.2 4.4.2.2 步骤
a) 试验条件:温度为 18℃~25℃,压力为当地的环境大气压;
b) 将采血管进行编号,考察管依次为 1~40;
c) 按照标准的采血操作流程进行采血,每个人采 1 支管,采血后立刻进行摇匀(按照制造商规定的摇匀次数),然后竖直放置在试管架上静置;
d) 当全部 40 个人采完血后,开始记时;
e) 30min 后将 40 支管一次全部放入离心机中进行离心操作;
g) 离心完毕,取出 40 支管观察并记录有无纤维蛋白挂壁现象。
6.4.5 4.5 溶血情况
6.4.5.1 4.5.1 要求
按照 4.4.2.2 的步骤进行测试,采血管采血后进行离心,不应出现溶血(排除临床原因)。
6.4.5.2 4.5.2 验证方法
a) 按照 4.4.2.1、4.4.2.2a)~f)的内容进行操作;
6.4.6 4.6 抗凝管的凝血情况
6.4.6.1 4.6.1 要求
按照 4.4.2.2 的步骤进行采血,抗凝管中充分混匀的血液标本在显微镜下观察应无凝块。
6.4.6.2 4.6.2 验证方法
a) 按照 4.4.2.1、4.4.2.2 a)~d)的内容进行操作;
注:4.4~4.6三项指标的评价可以结合临床性能评价一起进行测试。
6.4.7 4.7 无菌
6.4.7.1 4.7.1 要求
真空采血管内腔应无菌,即按照 4.7.2.3 的步骤进行测试,结果判定为合格。
6.4.7.2 4.7.2 验证方法
6.4.7.2.1 4.7.2.1 试剂
75%酒精溶液;75%酒精棉球;硫乙醇酸盐液体培养基;改良马丁培养基;0.9%无菌氯化钠溶液。
6.4.7.2.2 4.7.2.2 仪器
隔水式恒温培养箱;生化培养箱;生物显微镜;自动高压灭菌器;电热恒温干燥箱;酒精灯;火机;镊子。
6.4.7.2.3 4.7.2.3 步骤
b) 供试液的制备:含液体的采血管如凝血功能检测管、血沉检测管,以其管内含有的液体为供试液;不含液体的¢16mm×100mm 采血管用 5mL0.9%无菌氯化钠溶液进行振荡溶解,作为供试液备用;不含液体的¢13mm×100mm 的采血管用 4mL0.9%无菌氯化钠溶液进行振荡溶解,作为供试液备用;不含液体的¢13mm×75mm 的采血管用 3mL0.9%无菌氯化钠溶液进行振荡溶解,作为供试液备用;
c) 供试样品的培养:将供试液置于装有硫乙醇酸盐液体培养基、改良马丁培养基的容器中进行培养;
d) 培养及观察:上述含培养基的容器按规定的温度(细菌 30℃~35℃,真菌 23℃~28℃)培养14d。培养期间应逐日观察并记录是否有菌生长。若出现异常时则每天上、下午各观察一次。
如在加入供试品后或在培养过程中,培养基出现浑浊,培养 14d 后,不能从外观上判断有无菌生长,可取该培养液适量转种至同种新鲜培养基中或划线接种于斜面培养基上,细菌培养 2d,真菌培养 3d,观察接种的同种新鲜培养基是否再出现浑浊或斜面上有无菌生长;或用接种环取培养液涂片,染色,镜检,进行判断是否有菌生长。
e) 阴性对照:取同一批号空白硫乙醇酸盐流体培养基、改良马丁培养基各一支作为阴性对照。阴性对照不得有菌生长。
f) 阳性对照:在生物安全柜操作,接种金黄色葡萄球菌至营养肉汤培养基中,30℃~35℃培养18h~24h。用 0.9%无菌氯化钠溶液制成小于 100CFU/mL 的菌悬液。菌悬液制备后保存在 2℃~8℃,24h 内使用。接种 1mL 小于 100CFU 的金黄色葡萄球菌菌悬液于硫乙醇酸盐流体培养基中,应生长良好。
g) 结果判定:当供试品管液体均显澄清,阴性对照管液体均显澄清,阳性对照管液体显浑浊时供试品管为合格;当阴性对照管液体显澄清,阳性对照管液体显浑浊,供试品管液体显浑浊时供试品管为不合格;当阴性对照管液体显浑浊或阳性对照管液体显澄清时,实验无效。
6.4.8 4.8 结果可比性
6.4.8.1 4.8.1 确定需要进行结果比对的检测项目
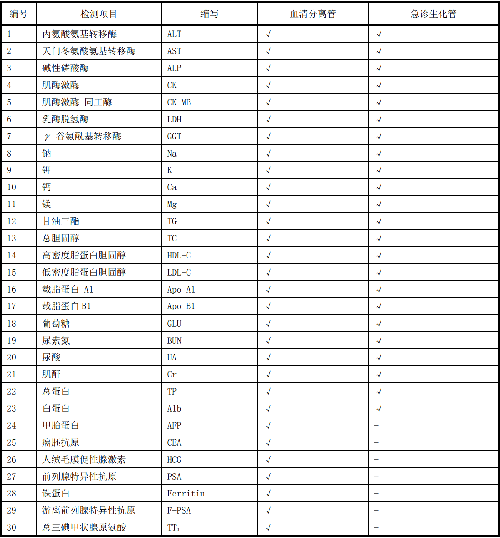
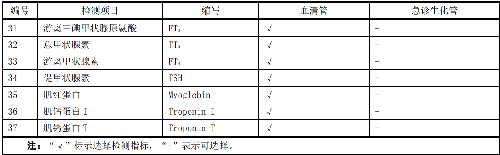
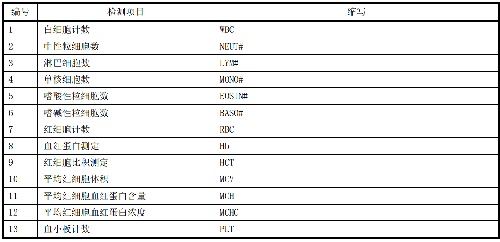
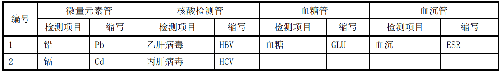
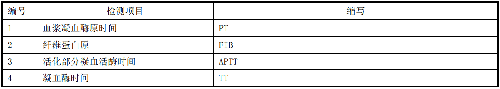
一般情况下,应对临床检测报告上的检测项目进行可比性验证,可优先对附录B中的检测项目进行验证。
6.4.8.2 4.8.2 确定用于检测的检测仪器
实施结果比对时,应对用于检测临床样本的检测系统进行可比性验证。
6.4.8.3 4.8.3 比对样本
6.4.8.3.1 4.8.3.1 样本选择
6.4.8.3.2 4.8.3.2 样本浓度水平
样本浓度应在方法的线性范围内,并覆盖医学决定水平。分析样本的浓度应尽可能在线性范围内均匀分布。
6.4.8.4 4.8.4 要求
可比性验证的可接受标准应满足临床需要,同时考虑检测系统的性能状况。
不同项目分析质量要求可采用国家认可机构设置的分析质量的最低标准。
采血管不同项目比对结果的相对偏倚若符合分析质量要求,表明考察管可满足临床应用要求。
6.4.8.5 4.8.5 验证方法
6.4.8.5.1 4.8.5.1 采血管选择
只需使用两种不同的采血管一个批号的产品同时采血进行实验,一种是比对管,一种是考察管。
6.4.8.5.2 4.8.5.2 样本要求
至少分析20个不同的临床患者样本。只有在室内质控合格的情况下,实验室数据才有效。
6.4.8.5.3 4.8.5.3 线性回归分析
4.8.5.3.1 拟合线性回归方程以比对管的检测值为X,考察管的检测值为Y进行线性拟合。利用所有样本测定的有效数据,线性回归方程见式(3):
Y=bX+a ......................................... (3)
式中:
b----直线的斜率;
a----直线的截距;
Y----考察管的检测值。
4.8.5.3.2 计算线性回归相关系数利用所有样本测定值进行线性回归后得相关系数(以r或R2 表示)。
4.8.5.3.3 线性回归相关系数判定如果r≥0.975(或R2≥0.95),则认为选择的数据范围适合,数据满足要求。该分析的误差可以由数据范围给以适当补偿,并且可以采用简单的线性回归方程来评价斜率和截距。
如果R2<0.95,那么必须通过分析另外一些样品以扩大数据范围,然后再检查全部数据系列,如仍然R2 <0.95,则应寻找待评价方法存在的缺陷,纠正后重新进行试验。
6.4.8.5.4 4.8.5.4 相对偏倚的计算及判定
4.8.5.4.1 相对偏倚的计算将医学决定水平(以Xc表示)代入式(3),得到预期偏倚(以Bx表示),其计算见式(4):
Bx=a+(b-1)Xc ..................................... (4)
式中:
Xc----医学决定水平;
b ----式(3)中的直线的斜率;
a ----式(3)中的直线的截距。
从而相对偏倚(relative bias,简写为Rb)的计算见式(5):
Rb=Bx/Xc×100%...................................... (5)
式中:
Xc----医学决定水平;
Rb----相对偏倚。
4.8.5.4.2 相对偏倚的判定不同检测项目的相对偏倚应符合国家认可机构设置的分析质量的最低标准。
6.4.8.6 4.8.6 可比性验证结果不符合要求的处理措施
对于不符合可比性验证要求的采血管,应分析原因,必要时采取相应的纠正措施,其后应对其进行比对,确认比对结果符合分析质量要求。
9 参考文献
[1] Validation and Verification of Tubes for Venous and Capillary Blood Specimen Collection; Approved Guideline. CLSI document GP34-A.
[2] Method Comparison and Bias Estimation Using Patient Samples; Approved Guideline – Second Edition (Interim Revision). CLSI document EP09-A2-IR.
[3] Procedures for the Handling and Processing of Blood Specimens for Common Laboratory Tests; Approved Guideline – Fourth Edition. CLSI document GP44-A4.
[4] User Verification of Performance for Precision and Trueness; Approved Guideline – Second Edition. CLSI document EP15-A2.
[5] Tubes and Additives for Venous and Capillary Blood Specimen Collection; Approved Standard – Sixth Edition. CLSI document GP39-A6.
[6] YY/T 0314—2007 一次性使用人体静脉血样采集容器