5 概述
肠扭转手术用于肠梗阻的手术治疗。 小肠扭转是一种严重的肠梗阻情况。它将导致部分肠系膜血管或全肠系膜血管阻塞而有部分或全部小肠坏死。因此,应急速解除扭转恢复肠系膜血管的循环。小肠扭转的病例除有肠梗阻的症状外,因有肠系膜血管堵塞尚有早期休克症状。
6 小肠相关解剖
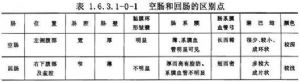
小肠系指胃幽门至盲肠间的肠管,含十二指肠,空肠与回肠。空肠与回肠是小肠的主要部分,通称小肠。空肠与回肠是腹腔中面积最大,高度活动的器官。起始于Treitz韧带(十二指肠空肠曲)盘曲于中腹部与下腹部,部分为大网膜及结肠所覆盖。若患者无腹部手术史,手术时从左上腹取出的小肠多为空肠,从盆腔取出者多半为回肠。空肠与回肠间无明显的分界线,但在结构上有若干区别点(表1.6.3.1-0-1)。手术时,可借助这些区别点,辨认空、回肠。肠管有一定的伸缩性,故在活体与标本测量的长度不一致。一般测量的结果是空、回肠长6m。现在认为最适合的方法是从鼻放置细聚乙烯管让其自然到达回盲部,测量其长度。用此方法测得空、回肠的长度为2.6m。小肠上部的2/5为空肠,下部3/5为回肠。
小肠系膜甚宽,附着于第2腰椎左侧腹后壁,向右斜行至右骶髂关节之下。肠系膜内含有血管、神经、淋巴管、淋巴结及脂肪。肠系膜附着部能防止扭转,影响循环。手术时,根据系膜的走向能辨别游离肠段的近、远端。肠系膜根部至肠缘的距离在小肠起始部为最短,末端回肠部亦较短,而跨过脊柱的部分为最长,一般不超过20~25cm。
小肠的血供来自上肠系膜动脉,它是腹主动脉的第2个大分支。上肠系膜动脉自胰腺的钩状突部穿出,跨过十二指肠第3段,进入小肠系膜根部,然后分出右结肠动脉,回结肠动脉和10~20个小动脉分支(图1.6.3.1-0-1)。前2支动脉经腹膜后或系膜根部供应升结肠、盲肠及末端回肠。因此,当肠系膜上动脉损伤或梗死时,随损害部分的高低可引起空肠、回肠、在半结肠或部分空肠、回肠的缺血坏死。
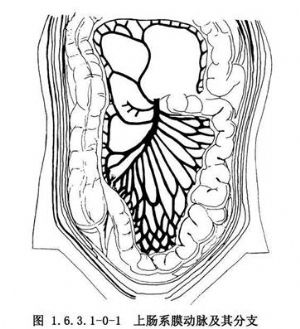
小肠动脉分支位于小肠系膜内,形成吻合网(动脉弓),再由动脉弓分出直支到达肠壁内。小肠上部系膜动脉弓仅一个(初级弓),直支较长,周围脂肪较少,愈向远端小肠动脉弓愈多。由初级弓分出动脉支吻合为2级、3级弓,动脉直支较短(图1.6.3.1-0-2)。系膜内脂肪亦较多。在肠系膜缘,血管又再分支。肠管壁的血管与环形肌层平行走行,先后穿过浆膜,肌层和黏膜下层。主要的动脉分支与直支被破坏后,这些血管供应的肠管便易发生坏死。

小肠静脉的分布与动脉大致相同。最后汇合成为肠系膜上静脉。它与上动脉并行,在胰颈的后方与脾静脉汇合形成门静脉。肠系膜上静脉损伤或发生栓塞时,也可致小肠静脉充血、坏死和腹膜炎。
小肠肠壁分为浆膜、肌肉和黏膜3层。肌肉又分为外层纵肌和内层环肌。黏膜下层为较强的弹力纤维与结缔组识。不论用哪种方式缝合肠壁,缝线必需通过这一层。
小肠黏膜下层有聚合淋巴结与淋巴板(Peyer’s patches),尤以回肠部为多。小肠部的淋巴流入肠壁、邻近血管弓部与上肠系膜动脉主干部等3个部位的淋巴结,然后进入乳糜池。
小肠的主要生理功能是消化和吸收。除胰液、胆液及胃液等可继续在小肠内起消化作用外,小肠黏膜腺体也能分泌含有多种酶的碱性肠液。其中主要的是多肽酶(肠肽酶)。它能将多肽变为可由肠黏膜吸收的氨基酸。食糜在小肠内分解为葡萄糖、氨基酸、脂肪酸后,即被小肠黏膜吸收。小肠黏膜上有很多绒毛。每一个绒毛被柱状上皮细胞多层覆盖,含有一个毛细血管襻和淋巴管(乳糜管),因而使吸收面积大为增加,构成近10万m2的吸收面积。葡萄糖、氨基酸及40%脂肪酸系由毛细血管吸收,经过门静脉到达肝内。其余60%脂肪酸则由乳糜管吸收,到达乳糜池及胸导管内。除食物外,胃液、胆液、胰液,肠液内的电解质,以及摄入的大量电解质也在小肠内被吸收进入血液循环。小肠被大量切除后,营养的吸收将受到影响。吸收最差的是脂肪,其次是蛋白质。碳水化合物是易被吸收的营养物质。根据临床实践,空肠与回肠保留100cm以上,并有回盲部,经过机体的代偿,仍能维持营养的消化,吸收。末段回肠对蛋白质、脂肪、碳水化合物有良好的吸收功能,并具有对某些微量物质(铜、维生素B12)与胆汁的特定吸收功能。因此,大量小肠切除后,虽然切除的长度相当,但营养不良在回肠被切除的病例较为明显。
小肠是产生免疫球蛋白的场所,特别是IgA。一般认为它由laminal propria的血浆细胞产生。
小肠也可以产生缩胆素(cholecys tokinin)、促胰酶素(pancreozymin)、肠高糖素(enteroglucagon)、肠血管活性肽(VIP vasoactive intestinal peptide)、胃抑制多肽(GIP gastric inhibitory polypetide)、生长抑素(somatostatin)等物质。这些物质直接影响消化系统其他器官如胆囊、胰腺等的功能。
肠黏膜尚具有屏障功能,能阻挡肠腔内细菌、毒素越过肠壁进入淋巴系统或门静脉内。
小肠由自主神经系统支配。交感神经纤维自第9、第10脊髓节分出,进入上肠系膜神经节。节后神经伴随肠系膜上动脉进入小肠。副交感神经节前纤维通过迷走神经与肠内神经丛的神经元相接。刺激副交感神经,则增加肠管之张力和运动及肠腺分泌。刺激交感神经,则肠管之张力松弛,运动受抑制,且血管收缩。肠内神经包括肠肌内Auerbach神经丛和黏膜下Meissner神经丛两部分。刺激肠肌丛部分使肠管平滑肌收缩,刺激黏膜下丛部分抑制平滑肌。
小肠的肌肉有节段性收缩和蠕动两种运动型式。前者是局部周径收缩。上段小肠每分钟约收缩9次,远段小肠每分钟收缩11次。这一动作使肠内容物得到搅拌,使之与更大范围的黏膜相接触。蠕动为小肠自上而下的收缩,每分钟1或2次,1次数厘米。在消化吸收过程,小肠有自上而下的环形收缩,起自胃或十二指肠,每分钟推移6~8cm,每次持续4~5min。小肠的运动受肌浆蛋白因子(myogentic factor)、神经原性因子(neurogenic factor)与内分泌因子(hormonal factors)的调控。
综上所述,小肠是人体吸收营养的主要器官,它具有极其强大的代偿功能。尽管如此,外科医师在处理小肠病变时,仍应考虑到这些功能的重要性,要尽量保留可保留的肠管。
7 适应症
肠梗阻可因粘连束带、扭转、套叠、肠管病变、狭窄、肠内异物、肿瘤等引起。可以是急性发作也可以是慢性发作。梗阻可以是完全性的,也可以是部分性的。当经非手术治疗无效或出现腹膜炎症状时为解除梗阻,可以根据梗阻的程度与肠襻的血运情况,采用不同的手术方式。术前应对病人的重要器官功能及内稳态的情况进行检查:如有器官功能严重障碍,宜先行纠正,慎重考虑手术的时机。
8 术前准备
肠梗阻病人常因呕吐、胃肠减压、不能进食而有内稳态失衡,慢性肠梗阻病人更可能有营养不良。因此,在术前应对内稳态进行调整使之恢复正常,即使在急性梗阻的情况下也应做这方面的处理。在慢性梗阻病人则更可以进行较全面的检查与治疗,且可对营养状态加以调理,改善病人的营养状态。应用肠外营养支持可获得满意的效果。
由于水、电解质与酸碱紊乱以及营养不良,尤其是那些病程较长的慢性肠梗阻病人,术前应对肝、肾功能进行监测、处理。防止手术而加重这些器官的损害。
10 手术步骤
进入腹腔后即可见肠襻呈瘀血状且有血性腹水。此时,可以左手提起一段肠襻,右手循系膜向系膜根部探查。从横结肠系膜根部或下腹部找到扭转的系膜根部。辨清扭转的方向,确定顺钟向还是逆钟向。一般逆钟向多于顺钟向。辨认清楚后,将整个小肠向扭转的相反方向恢复(图1.6.3.1-1)。可以是180°~720°扭转。复位后,应判断肠管是否仍有生机。

11 术中注意要点
小肠扭转复位及处理后,小肠的循环将有所恢复,但肠管是否仍有生机,有时甚难判断,需要反复处理及观察。一般可根据下述几点来判定肠管的生机:①肠管及系膜有无严重淤血及出血点;②肠浆膜层的色泽是否正常;③有无肠蠕动存在;④系膜静脉有无血栓;⑤系膜动脉及肠缘动脉有无搏动;⑥腹腔内有无臭味。其中动脉搏动是重要的标志。如有可疑,可在肠系膜根部或肠系膜的较大分支部用普鲁卡因、苄胺唑啉或罂粟碱注射解除血管痉挛,恢复动脉搏动。当肠管循环存在时,病人吸入纯氧后,肠管的颜色能很快地由发绀转为红色。若有准备,亦可在动脉注射荧光素,再用紫外线灯照射,可估计血液灌注的范围。多普勒超声仪也可用来检测该区域肠系膜动脉供血的情况。
经观察证实全部小肠的血运已恢复,可吸净腹腔内的渗液并以温等渗盐水清洗。这些渗液中含有大量细菌与毒素,清除后可减轻机体因吸收这些毒素而产生的症状。其后,仔细观察与检查肠管是否还有区域性坏死或是损破,若有,则可给予切除,修补等相应处理。处理完善后,腹腔内放置引流。全小肠扭转在复位后虽恢复了血液循环,但应考虑到肠黏膜不能耐受缺血,时间稍长(>6h)即可产生坏死脱落。因此,在那些发病时间较长的病人,除术后对腹部严密观察外,还应考虑在24h后进行二次观察剖腹探查术(second-look laporotomy)。如有肠管出现延迟性坏死,可再做切除或旷置造口术。
局部节段性小肠坏死可做部分切除吻合,切除线应在肯定的健康肠管组织上。血循环有障碍的肠管切除得不够将导致术后发生吻合口瘘等严重并发症。但是,过多地切除小肠则会影响病人日后营养的消化与吸收功能出现短肠综合征。需要术者认真判断肠切除的范围。
小肠扭转可以是全小肠扭转,也可以是以部分粘着的小肠为轴而扭转,还有的是腹腔内有间隙、内疝,小肠进入后扭转。在这些情况下,除解除扭转外还应消除这些造成扭转的原因。
12 术后处理
肠扭转手术术后做如下处理:
小肠扭转有肠管的阻塞,也有肠系膜血管的阻塞。其病理生理改变远较单纯的肠管阻塞为严重。有明显的内稳态紊乱,腹腔内渗出液多,细菌与毒素进入腹膜腔的量大,易造成腹膜炎。故术后应重视水、电解质、酸碱平衡的纠正,输入胶体以维持胶体渗透压。必要时可给予肾上腺皮质激素,减轻机体的应激状态。
腹腔内放置引流,特别是双套管负压引流以减少腹膜炎的发生。肠梗阻、肠血循环障碍都是肠细菌易位的诱因,可以引起肠源性感染。术后加强广谱抗生素与抗厌氧菌药物的应用实为必要。
肠缺血时间稍长后,肠黏膜将坏死成溃疡、出血。有时出血量甚多,可造成休克,且多在术后2周左右出现。除观察外,可给予肠外营养使肠道休息。亦可给予生长抑素(somatostatin)等控制胃肠液的分泌,减少消化液对屏障已被损坏的黏膜的再一步损害。
对肠管缺血时间长的病人,应考虑做小肠外置造口,既旷置了病变最重的部分又提供了直接观察肠黏膜改变的窗口。
为了使病人能保留有一定长度的肠管,有时对那些活力处于临界状态的肠管不得不加以保留。这些病人术后24h的观察必需很仔细,当发现有肠管失去活力的征象时应立即再剖腹处理。但是,有些病人的肠管虽已失去活力但腹部或全身并无症状出现。为进一步了解保留的肠管是否成活,可在24h后再次剖腹观察(二次剖腹探查)并做相应的处理。再次剖腹观察在这些病人十分必要,是一种保证安全的措施,以免坏死的肠管遗留在腹内,产生严重的后果。
再次剖腹观察通常在全身麻醉下进行,拆除第1次手术的腹壁切口缝线后进入腹腔,观察腹腔内是否有血性腹水、肠管是否有失活状态。值得注意的是不要遗漏局灶性的肠管坏死。根据发现的情况给予全部、部分或节段肠切除吻合。