3 基本信息
ICS 11.080
C 59
中华人民共和国卫生行业标准WS/T 647—2019《溶葡萄球菌酶和溶菌酶消毒剂卫生要求》(Hygienic requirement for lysostaphin and lysozyme disinfectants)由中华人民共和国国家卫生健康委员会于2019年01月30日《关于发布〈过碳酸钠消毒剂卫生要求〉等6项推荐性卫生行业标准的通告》(国卫通〔2019〕4号)发布,自2019年07月01日起实施。
4 发布通知
关于发布《过碳酸钠消毒剂卫生要求》等6项推荐性卫生行业标准的通告
国卫通〔2019〕4号
现发布《过碳酸钠消毒剂卫生要求》等6项推荐性卫生行业标准,编号和名称如下:
WS/T 647—2019 溶葡萄球菌酶和溶菌酶消毒剂卫生要求
WS/T 651—2019 医用低温蒸汽甲醛灭菌指示物评价要求
上述标准自2019年7月1日起施行。
特此通告。
国家卫生健康委员会
2019年1月30日
5 前言
本部分按照 GB/T1.1-2009 给出的规则起草。
本部分起草单位:上海市疾病预防控制中心、中国疾病预防控制中心环境与健康相关产品安全所、复旦大学。
本部分主要起草人:田靓、朱仁义、袁政安、沈伟、沈瑾、邱侠、陆婉英、黄青山、李国栋、陆晔、赵晓蔚、黄晋江、吴宏宇。
6 标准正文
6.1 1 范围
本标准规定了溶葡萄球菌酶和溶菌酶消毒剂的原料要求、技术要求、应用范围、使用方法、运输贮存和包装、标签标志和介绍、检验方法。
本部分适用于以溶葡萄球菌酶和(或)溶菌酶为主要杀菌成分的酶类消毒剂。
6.2 2 规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 191 包装储运图示标志
GB 27950 手消毒剂卫生要求
GB 27951 皮肤消毒剂卫生要求
GB 27954 黏膜消毒剂卫生要求
中华人民共和国药典(2015年版)
消毒技术规范(2002年版)卫生部 (卫法监发〔2002〕282号)
消毒产品标签介绍管理规范 卫生部(卫监督发﹝2005﹞426号)
6.3 3 术语和定义
下列术语和定义适用于本文件。
3.1
酶类消毒剂 enzyme disinfectant
以酶为主要杀菌成分的消毒剂。
3.2
溶葡萄球菌酶 lysostaphin
3.3
溶菌酶 lysozyme
能水解细菌中黏多糖的酶。亦称胞壁质酶、N-乙酰胞壁质聚糖水解酶。
3.4
酶活性单位 enzyme activity unit
酶活性的度量单位。1个酶活性单位指在特定条件下,在单位时间内转化单位底物(或转化底物中单位有关基团)的酶量。
6.4 4 原料要求
6.4.1 4.1 溶葡萄球菌酶
白色或微黄色粉末,无臭、易溶于水;按干燥品计算,酶活性单位应≥100U/mg。
6.4.2 4.2 溶菌酶
符合国家药品标准中溶菌酶的要求。
6.4.3 4.3 生产用水
6.4.4 4.4 其他原料
为食品级或化学纯或符合药典规定的原料,符合国家有关规定,不得使用工业级。
6.4.5 4.5 禁用物质
不应含有抗生素、抗真菌药物、激素以及国家规定的其他禁用物质。
6.5 5 技术要求
6.5.1 5.1 外观
不分层、无沉淀和悬浮物、无异味。
6.5.2 5.2 理化指标
5.2.1 pH 值
pH值为5.0~8.0。
5.2.2 有效含量
消毒剂中溶葡萄球菌酶的活性范围为0.5U/mL~20U/mL,溶菌酶的活性范围为10000U/mL~200000U/mL。
产品有效成分含量在设定值或标示中心值的80%~150%之内。
5.2.3 稳定性
≥12个月。
6.5.3 5.3 杀灭微生物指标
作用浓度和时间按产品标签介绍的要求,杀灭微生物指标应符合表1要求。
用于手消毒应符合GB 27950的要求;用于皮肤消毒应符合GB 27951的要求;用于黏膜消毒应符合GB 27954的要求。
表1 杀灭微生物指标
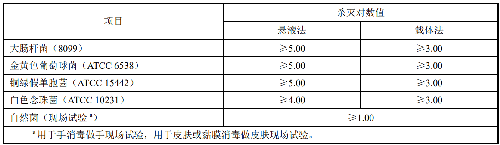
a 用于手消毒做手现场试验,用于皮肤或黏膜消毒做皮肤现场试验。
6.6 6 应用范围
6.7 7 使用方法
6.7.1 7.1 手消毒
7.1.1 卫生手消毒
取适量消毒剂于手心,双手互搓使均匀涂布每个部位,作用时间符合GB 27950的要求。
7.1.2 外科手消毒
外科洗手后,取适量消毒剂均匀涂布于双手、前臂和上臂下1/3的皮肤,作用时间符合GB 27950的要求。
6.7.2 7.2 皮肤消毒
7.2.1 完整皮肤
取消毒剂原液,或将消毒剂原液用符合《中华人民共和国药典(2015年版)》的纯化水或无菌水稀释至介绍规定浓度,均匀喷雾或用医用棉拭子擦拭皮肤表面,作用时间应符合GB 27951的要求。
7.2.2 破损皮肤
从原包装倒出后一次性使用。取消毒剂原液,或将消毒剂原液用符合《中华人民共和国药典(2015年版)》的无菌水稀释至介绍规定浓度,冲洗破损皮肤表面,作用时间应符合GB 27951的要求。
6.7.3 7.3 黏膜消毒
7.3.1 口腔黏膜
从原包装倒出后一次性使用。用消毒剂原液,或将消毒剂原液用符合《中华人民共和国药典(2015年版)》的纯化水或无菌水稀释至介绍规定浓度,均匀喷雾或用医用棉拭子擦拭或含漱,作用时间按照介绍,最长作用时间5min。
从原包装倒出后一次性使用。用消毒剂原液,或将消毒剂原液用符合《中华人民共和国药典(2015年版)》的纯化水或无菌水稀释至介绍规定浓度,用医用棉拭子擦拭或灌洗或冲洗,作用时间按照介绍,最长作用时间5min。
6.8 8 运输、贮存和包装
6.8.1 8.1 运输
运输产品时应避免日晒、雨淋。不可与有异味或影响产品质量的物品混装运输。
6.8.2 8.2 贮存
室温或阴凉处保存,避光、密闭、干燥,不可与有异味或影响产品质量的物品同处贮存。
6.8.3 8.3 包装
产品的包装无毒和清洁,包装材质符合相应材料的化妆品包装要求。产品的包装密封,能保证产品的稳定性以及在储存运输、使用过程中的安全性。包装储运图示标志应符合GB∕T l91要求。
6.9 9 标识要求
6.9.1 9.1 标签和介绍
6.9.2 9.2 注意事项
介绍至少包括以下内容:
——避免接触拮抗物。不能与阴离子表面活性剂、Ba2+、Ca2+、Mg2+等同时使用。
——置于儿童不易触及处。
——对蛋白质过敏者慎用。
6.10 10 检验方法
6.10.1 10.1 外观
6.10.2 10.2 pH 值测定
6.10.3 10.3 有效含量测定
10.3.2 溶菌酶活性测定
6.10.4 10.4 稳定性测定
按《消毒技术规范(2002年版)》的方法,用微生物法进行稳定性实验。有效期<24个月,用自然留样法测定;有效期为24个月,根据产品性能,选用37℃存放90d的方法,或用自然留样法测定。在有效期内,有效成分含量不得低于标示量的下限值。
6.10.5 10.5 杀灭微生物试验
按《消毒技术规范(2002年版》有关规定测定。宜采用悬液法;若选用载体法时,应采用非吸附性材料(金属、玻璃、猪皮等)做载体。
7 附录A(规范性附录)溶葡萄球菌酶酶活性测定
7.1 A.1 原理
以偶联活性艳蓝染料KNR的金黄色葡萄球菌细胞壁肽聚糖(KNR-PG)为色源底物,根据酶作用过程中定量地释放带有KNR染料基团的小分子可溶性片段产物,在除去未反应的不溶性底物后,对上清液进行比色测定溶葡萄球菌酶酶活性。
在pH10.0的1.2mL反应体系下,37℃温度下,在波长595nm处,每分钟使KNR-PG溶液吸光度值增加0.35的酶量为1个溶葡萄球菌酶酶活性单位。
7.2 A.2 试剂
A.2.1 溶葡萄球菌酶标准品溶液:按照溶葡萄球菌酶活性单位定义,对溶葡萄球菌酶冻干粉进行标定。需要时,用Tris-HCl缓冲液溶解,配制成0.9 U/mL的标准品溶液,-20 ℃贮存,每次试验用1支,避免反复冻融。
A.2.6 甘氨酸-氢氧化钠缓冲液:0.2 mol/L,pH 10.0。
A.2.7 三羟甲基氨基甲烷盐酸缓冲液(Tris-HCl缓冲液):0.05 mol/L,pH 7.5。
A.2.8 色源底物KNR-PG溶液:按照附录C方法制备色源底物KNR-PG,用甘氨酸-氢氧化钠缓冲液以1:5质量体积比例均匀悬浮。
7.3 A.3 试验步骤
7.3.1 A.3.1 标准曲线的制备
取洁净干燥的微量离心管6只,标号,按表A.1顺序每管中加入对应量的溶葡萄球菌酶标准品溶液(A.2.1),再加入不同量的0.2mol/L甘氨酸-氢氧化钠缓冲液(A.2.6)。然后按序号加入色源底物KNR-PG溶液(A.2.8)130μL,每管加入底物后迅速在旋涡混合仪上混匀。将加好溶液的微量离心管迅速移入37℃的恒温水浴锅中定时反应20min。从水浴中取出微量离心管,每管中加入300µL95%乙醇终止反应,10000r/min离心10min,离心结束后,取上清液于595nm处,以0号管为空白测定吸光度。根据测得的吸光度值及相对应的标准品溶葡萄球菌酶酶活性(U/mL),求得线性回归曲线:
C0=(A-B)/K…………………(A.1)
式中:
A——吸光度;
B——截距;
K——标准曲线的斜率。
表A.1 标准曲线制备
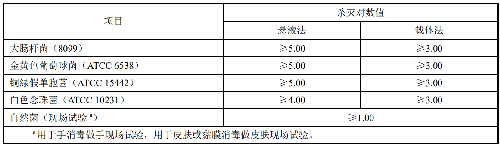
7.3.2 A.3.2 样品的测定
待测样品的测定方法同标准曲线,取50µL用于测定。平行测定3次,计算平均值。
7.4 A.4 结果计算
C = C0×V反/V样×N…………………(A.2)
式中:
V反——反应体系体积,为0.9mL;
V样——样品加入体积,为0.05mL;
N——样品稀释倍数。
8 附录B(规范性附录)溶菌酶酶活性测定
8.1 B.1 原理
溶菌酶通过溶解革兰阳性菌细胞壁使细菌溶解,菌液在可见光范围内的吸光度降低,以溶壁微球菌为底物,用分光光度法,以450nm波长处菌液单位时间内吸光度降低程度测定溶菌酶酶活性。在室温25℃、pH为6.2时,在波长450nm处,每分钟引起吸收度下降0.001为1个溶菌酶酶活性单位。
8.2 B.2 试剂
B.2.1 磷酸盐缓冲液:取磷酸二氢钠10.4 g与磷酸氢二钠7.86 g及乙二胺四乙酸二钠0.37 g,加水溶解至1000 mL,调节pH至6.2。
B.2.2 溶壁微球菌[Micrococcuslysodeik,CGMCC1.0634]。
8.3 B.3 试验步骤
量取样品,用磷酸盐缓冲液稀释成约1000U/mL的溶液,稀释所用倍数记为N。
B.3.2 底物悬浮液的制备
临用前配制。称取溶壁微球菌15mg~20mg,加磷酸盐缓冲液0.5mL~1mL,在研钵内研磨3min,再加磷酸盐缓冲液适量,使总体积约为50mL,悬浮液于25℃±0.1℃在450nm波长处测得的吸收度为0.70±0.05。
B.3.3 样品测定
量取25℃±0.1℃的底物悬浮液3mL,置比色池中,在450nm的波长处测定吸收度,作为0s的读数A0,然后量取25℃±0.1℃的供试品溶液0.15mL(相当于溶菌酶7.5μg),加到比色池中,迅速混匀,用秒表计时,至60s时再测定吸收度A;同时量取磷酸盐缓冲液0.15mL,同法操作,做为空白试验,测得0s的读数A'0及60s的读数A'。
平行测定3次,计算平均值。
8.4 B.4 结果计算
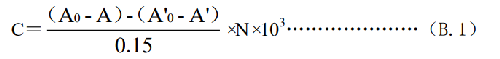
式中:
N ——稀释倍数。
9 附录C(规范性附录)溶葡萄球菌酶色源底物制备
9.1 C.1 试剂
C.1.1 三氯乙酸(TCA)
C.1.2 0.05mol/L三羟甲基氨基甲烷盐酸缓冲液(Tris-HCl)
取三羟甲基氨基甲烷6.0g,加水800mL溶解,用盐酸调节pH至7.5后,用水稀释至1000mL。
取氢氧化钠10.0g,加水1000mL溶解。
C.1.4 其他试剂
金黄色葡萄球菌、生理盐水、胰蛋白酶、艳蓝染料(KNR染料)、叠氮钠、纯水。
9.2 C.2 制备方法
C.2.1 按照《消毒技术规范(2002年版)》有关规定制备金黄色葡萄球菌悬液。
C.2.2 对菌悬液121℃ 20min灭菌后进行离心,收集菌体。
C.2.4 用7倍菌体质量的10%TCA溶液悬浮菌体,4℃放置72h。
C.2.6 用5倍菌体质量的5%TCA溶液悬浮菌体,90℃水浴10min。
C.2.8 用5倍菌体质量的Tris-HCl悬浮菌体,按0.5mg/mL浓度加入胰蛋白酶,置于37℃水浴24h。
C.2.11 用少量纯水悬浮菌体,于4℃下对纯水透析24h。
C.2.12 离心,收集沉淀。
C.2.13 按7倍菌体质量,配制0.25N的氢氧化钠溶液适量。
C.2.14 用配制好的0.25N的氢氧化钠溶液的一半体积悬浮菌体。
C.2.15 按1/7的菌体质量称取KNR染料,用剩余的氢氧化钠溶液进行溶解。
C.2.16 在悬浮的菌液中加入配制好的染料,37℃水浴24h。
C.2.17 离心,纯水洗涤至上清液无色,用少量纯水悬浮菌体,转移至保存容器内,按10mg/L浓度加入叠氮钠,4℃保存。