3 基本信息
ICS 11.020
C 55
中华人民共和国卫生行业标准WS/T 677—2020《人群维生素D缺乏筛查方法》(Method for vitamin D deficiency screening)由中华人民共和国国家卫生健康委员会于2020年05月06日《关于发布〈人群维生素D缺乏筛查方法〉等2项推荐性卫生行业标准的通告》(国卫通〔2020〕8号)发布,自2020年11月01日起实施
4 发布通知
关于发布《人群维生素D缺乏筛查方法》等2项推荐性卫生行业标准的通告
国卫通〔2020〕8号
现发布《人群维生素D缺乏筛查方法》等2项推荐性卫生行业标准,编号和名称如下:
上述标准自2020年11月1日起施行。
特此通告。
国家卫生健康委
2020年5月6日
5 前言
本标准按照 GB/T 1.1—2009 给出的规则起草。
本标准起草单位:中国疾病预防控制中心营养与健康所、宁波市疾病预防控制中心、深圳市慢性病防治中心、深圳市计量质量检测研究院、南京医科大学、中粮营养健康研究院。
本标准主要起草人:杨丽琛、杨晓光、胡贻椿、金米聪、杨国武、周继昌、汪之顼、贾健斌、王俊、陈晓红、张协光、莫俊銮、毛德倩、付志成、王睿、丁叶、周明、陈竞、张森。
6 标准正文
6.1 1 范围
本标准规定了人群维生素D缺乏和不足筛查的指标、参考判定值和检测方法。
6.2 2 规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 603 化学试剂 试验方法中所用制剂及制品的制备
6.3 3 术语和定义
下列术语和定义适用于本文件。
3.1
25-羟基维生素 D 25-hydroxyvitamin D;25(OH)D
血液中维生素 D 的主要循环形式,稳定性好,是公认的评价人体维生素 D 营养状况的可靠指标,主要包括两种形式:25(OH)D2、25(OH)D3,其中 25(OH)D3是血液中维生素 D 的主要存在形式。
3.2
维生素 D 缺乏 vitamin D deficiency
当人体血清(或血浆)25-羟基维生素 D 含量低于缺乏的参考判定值时,可判定为维生素 D 缺乏。
3.3
维生素 D 不足 vitamin D insufficiency
当人体血清(或血浆)25-羟基维生素 D 含量低于正常人群的参考判定值,但高于缺乏参考判定值时,可判定为维生素 D 不足。
6.4 4 人群维生素 D 营养状况判定指标及参考判定值
6.5 5 测定方法
6.5.1 5.1 血液标本的采集与保存
6.5.2 5.2 第一法:液相色谱串联质谱法
6.5.3 5.3 第二法:化学发光免疫法
6.5.4 5.4 第三法:酶联免疫法
7 附录A(规范性附录)血液标本的采集与保存
7.1 A.1 标本采集
A.1.1 血液标本的采集:空腹静脉血,取血方法依据 WS/T 225 以及检测方法的要求采集空腹静脉血 1mL。
A.1.2 采血管:根据所需血清或血浆,使用不同采血管分装。
7.2 A.2 血清、血浆保存
标本于2 ℃~8 ℃可稳定7 d,-20 ℃可稳定12个月。若标本不能及时检测,建议适量分装后于-70 ℃以下存放标本,仅一次冻融。
8 附录B(规范性附录)液相色谱串联质谱法
8.1 B.1 原理
血清(血浆)中的25(OH)D2和25(OH)D3经甲醇/乙腈沉淀蛋白,采用正己烷萃取,氮气吹干,用初始流动相复溶,使用液相色谱法分离,串联质谱多反应监测模式(MRM)检测,同位素内标法定量,该方法可以分别测定25(OH)D2和25(OH)D3。
8.2 B.2 试剂和溶液
除非另有说明,本方法所有试剂均为分析纯,水符合GB/T 6682中一级用水规定,溶液按照GB/T 603配制。
8.2.1 B.2.1 试剂
B.2.1.1 25(OH)D2标准品(C28H44O2,CAS:21343-40-8):纯度>98%或有证标准物质。
B.2.1.2 25(OH)D3标准品(C27H44O2,CAS:19356-17-3):纯度>98%或有证标准物质。
B.2.1.3 同位素内标[2H3]-25(OH)D2标准品(C28H412H3O2,CAS:1217467-39-4):纯度>98%。
B.2.1.4 同位素内标[2H3]-25(OH)D3标准品(C27H412H3O2,CAS:140710-94-7):纯度>98%。
B.2.1.5 甲醇(CH3OH):色谱纯。
B.2.1.6 正己烷(C6H14):色谱纯。
B.2.1.7 甲酸(HCOOH):色谱纯。
B.2.1.9 氮气(N2):纯度≥99.9%。
B.2.1.12 乙腈(CH3CN):色谱纯。
B.2.1.15 标准储备溶液(10 μg/mL):分别称取25(OH)D2和25(OH)D3标准品1 mg(精确至0.01 mg)于2个100 mL容量瓶中,用甲醇溶解并定容至刻度。此溶液中25(OH)D2和25(OH)D3的浓度为10 μg/mL。溶液转移至试剂瓶中后,-20 ℃下避光保存,备用。
B.2.1.16 同位素内标标准储备溶液(10 μg/mL):分别称取同位素内标[2H3]-25(OH)D2和[2H3]-25(OH)D31 mg(精确至0.01 mg)于2个100 mL容量瓶中,用甲醇溶解并定容至刻度。此溶液中[2H3]-25(OH)D2和[2H3]-25(OH)D3的浓度为10 μg/mL。溶液转移至试剂瓶中后,-20 ℃下避光保存,备用。
B.2.1.17 标准系列溶液:分别准确移取25(OH)D2(10 μg/mL)和25(OH)D3(10 μg/mL)5 μL、10 μL、25 μL、50μL、125 μL、250 μL和500 μL于7个10 mL容量瓶中,用甲醇稀释并定容至刻度。此系列溶液的25(OH)D2和25(OH)D3的浓度为5 ng/mL、10 ng/mL、25 ng/mL、50 ng/mL、125 ng/mL、250 ng/mL和500ng/mL。
B.2.1.18 混合同位素内标溶液(100 ng/mL):分别准确吸取同位素内标[2H3]-25(OH)D2储备溶液(10μg/mL)和[2H3]-25(OH)D3储备溶液(10 μg/mL)各100 μL于10 mL容量瓶中,用甲醇稀释并定容至刻度。
此溶液的同位素内标[2H3]-25(OH)D2和[2H3]-25(OH)D3的浓度均为100 ng/mL。溶液转移至试剂瓶中后,-20℃下避光保存,备用。
8.2.2 B.2.2 仪器和设备
B.2.2.1 分析天平,感量:0.0001 g。
B.2.2.2 分析天平,感量:0.00001 g。
B.2.2.3 液相色谱-串联质谱联用仪。
B.2.2.6 旋涡混合器。
B.2.2.7 移液枪或移液器。
8.3 B.3 分析步骤
8.3.1 B.3.1 样品制备
取血清(血浆)样品200 μL至2 mL离心管中,加入20μL混合同位素内标溶液,涡旋振荡30 s。加入400 μL沉淀剂(甲醇+乙腈,1+1),室温下涡旋振荡混匀30 s;加入1.2 mL正己烷,室温下涡旋振荡5 min,然后在4 ℃和离心力大于12000×g下离心5 min;吸取1.0 mL上清液至1.5 mL离心管中,室温下用氮气吹至干;用100 μL初始流动相复溶,涡旋振荡30 s,4 ℃和离心力大于12000×g下离心5 min,上清液转移至进样瓶中待LC-MS/MS分析。
8.3.2 B.3.2 标准工作溶液制备
取7个2 mL离心管,分别加入180 μL空白替代血清样品(1%BSA牛血清白蛋白水溶液),以及20 μL标准系列溶液(B.2.1)和20 μL混合同位素内标溶液,此系列相当于0.5 ng/mL~50 ng/mL浓度范围。旋涡振荡30 s。以下操作同B.3.1。
8.3.3 B.3.3 液相色谱-串联质谱联用仪参数设置
B.3.3.1 液相色谱分析参考条件:
a) 色谱柱:C18柱(柱长 100 mm,柱内径 2.1 mm,填料粒径 1.7 μm,或者具同等柱效的色谱柱);
b) 流动相:A 相:含 0.1%甲酸的水溶液;B 相:含 0.1%甲酸的甲醇溶液;
c) 梯度洗脱:见表 B.1;
d) 流速:0.30 mL/min;
e) 柱温:40 ℃;
f) 进样体积:10 μL。
| 时间/min | 流动相A/% | 流动相B/% |
| 0 | 15 | 85 |
| 2.0 | 3 | 97 |
| 3.5 | 3 | 97 |
| 4.0 | 15 | 85 |
| 7.0 | 15 | 85 |
B.3.3.2 质谱测定参考条件:
c) 气帘气:0.25 MPa;
d) 喷雾电压:4000 V;
e) 去溶剂气温度:450 ℃;
f) 雾化气:0.35 MPa;
g) 去溶剂气:0.35 MPa;
h) MRM 离子对参数见表 B.2 所示。
| 目标化合物 | 母离子/(m/z) | 定量离子/(m/z) | 去簇电压/eV | 碰撞能量/eV |
| 25(OH)D2 | 413.2 | 355.2a 337.1 | 90 90 | 15 15 |
| [2H3]-25(OH)D2 | 416.2 | 358.2a 340.1 | 95 95 | 36 15 |
| 25(OH)D3 | 401.2 | 257.2a 365.3 | 100 100 | 19 22 |
| [2H3]-25(OH)D3 | 404.2 | 257.2a 368.3 | 100 100 | 19 20 |
| a 定量离子。 | ||||
8.3.4 B.3.4 定性测定
在同一色/质谱条件下进行标准溶液和样品溶液的测定,如果样品溶液中检出的色谱峰的保留时间与标准溶液中检出的色谱峰的保留时间一致,所选择的离子对的质荷比也一致,而且样品溶液中定性离子对的相对丰度与浓度相当的标准溶液中的定性离子对的相对丰度比较,相对偏差也不超过表B.3规定的范围,则可判定样品溶液中存在该物质。
| 相对离子丰度 | >50% | >20%~50% | >10%~20% | ≤10% |
| 允许相对偏差 | ±20% | ±25% | ±30% | ±50% |
8.3.5 B.3.5 工作曲线的制作
在B.3.3的液相色谱和串联质谱分析条件下,将B.3.2得到的标准工作溶液由低浓度到高浓度进行进样分析,以25(OH)D2和25(OH)D3色谱峰与其对应的同位素内标色谱峰的峰面积比值-浓度进行线性回归,得到标准工作溶液的直线拟合方程,其线性相关系数应大于0.99。
8.3.6 B.3.6 样品测定
在B.3.3的液相色谱和串联质谱分析参考条件下,将B.3.1得到的待测样品溶液进样分析,按内标法计算待测试样溶液中目标物的质量浓度。待测试样溶液中的目标物的质量浓度应在标准工作曲线的线性范围内,超过线性范围则应适当稀释样品后再重复处理测定。
8.3.7 B.3.7 空白试验
以1%BSA牛血清白蛋白水溶液代替血清(血浆)样品,按B.3.1的步骤做空白试验。
8.4 B.4 质量控制
8.4.1 B.4.1 内部质控
实验室应制定测试结果质量控制程序,明确内部质量控制的内容、方式和要求。随同样品检测需测定质量控制样品,绘制质量控制图,观察测试工作的稳定性、系统偏差及趋势,及时发现异常现象并采取相应的改进措施。
8.4.2 B.4.2 外部质控
实验室应参加国内外实验室认可机构组织的能力验证活动,参加国际间、国内同行间的实验室比对试验。根据外部评审、能力验证、考核、比对等结果评估检验结果的质量并采取相应的改进措施。
8.5 B.5 分析结果的计算
血清(血浆)样品中25(OH)D2和25(OH)D3的质量浓度按式(B.1)计算:
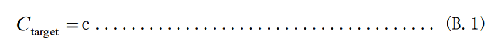
式中:
Ctarget——血清(血浆)样品中目标物的浓度,单位为纳克每毫升(ng/mL);
c——工作曲线中查出的样品浓度,单位为纳克每毫升(ng/mL);
注:结果用平行测定的算术平均值表示,保留小数点后一位,血浆(血清)中25(OH)D总含量为25(OH)D2和25(OH)D3含量相加。
8.6 B.6 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。
8.7 B.7 检出限和定量限
本方法25(OH)D2、25(OH)D3检出限均为0.15 ng/mL,定量限均为0.5 ng/mL。
8.8 B.8 回收率
本方法的添加回收率为84.0%~106.0%。
8.9 B.9 25-羟基维生素D2和 25-羟基维生素D3标准溶液LC-MS/MS色谱图
25(OH)D2和 25(OH)D3标准溶液的 LC-MS/MS 色谱图见图 B.1,[2H3]-25(OH)D2和[2H3]-25(OH)D3标准溶液的 LC-MS/MS 色谱图见图 B.2。
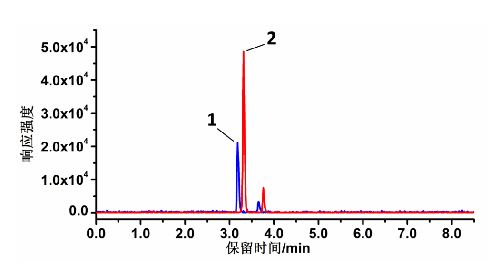
说明:
1——峰 1 为 25(OH)D3;
2——峰 2 为 25(OH)D2
图 B.1 25(OH)D2和 25(OH)D3标准溶液 LC-MS/MS 图
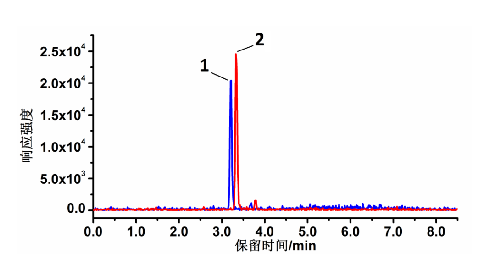
说明:
1——峰 1 为[2H3]-25(OH)D3;
2——峰 2 为[2H3]-25(OH)D2
图 B.2 [2H3]-25(OH)D2和[2H3]-25(OH)D3标准溶液 LC-MS/MS 图
9 附录C(规范性附录)化学发光免疫法
9.1 C.1 原理
依据化学检测体系中25(OH)D浓度与体系的化学发光强度在一定条件下呈线性定量关系的原理,利用仪器对体系化学发光强度的检测,进而确定25(OH)D含量的分析方法。
9.2 C.2 仪器和材料
C.2.3 25(OH)D定标液、质控品。
C.2.4 仪器基础试剂和耗材。
9.3 C.3 分析步骤
C.3.1 按化学发光免疫分析仪器操作说明和试剂盒使用说明,准备仪器、试剂、标准品和质控品等。
C.3.2 进行化学发光免疫分析仪系统测试以及25(OH)D总量检测试剂盒定标。
C.3.3 血清(血浆)标本应达到室温,混合均匀后进行测定,确保样品杯中无气泡。为了防止液体挥发影响结果,所有样品、标准品、质控品上机后都应在2h内测定。
C.3.4 严格按仪器操作说明要求进行标准品、质控品及样品的测定,并读取、保存、计算检测结果。
9.4 C.4 质量控制
9.4.1 C.4.1 内部质控
实验室应制定测试结果质量控制程序,明确内部质量控制的内容、方式和要求。随同样品检测需测定质量控制样品,绘制质量控制图,观察测试工作的稳定性、系统偏差及趋势,及时发现异常现象并采取相应的改进措施。
9.4.2 C.4.2 外部质控
实验室应参加国内外实验室认可机构组织的能力验证活动,参加国际间、国内同行间的实验室比对试验。根据外部评审、能力验证、考核、比对等结果评估检验结果的质量并采取相应的改进措施。
10 附录D(规范性附录)酶联免疫法
10.1 D.1 原理
样本中25(OH)D与其抗体结合,通过洗液除去非结合物,再加入酶标记的抗原或抗体,此时,能固定下来的酶量与样品中25(OH)D的量相关。通过加入与酶反应的底物显色后,于特定波长下检测吸光度,根据颜色的深浅可以分析样品中25(OH)D总量。
10.2 D.2 仪器和材料
D.2.1 恒温培养箱、酶标仪、洗板机。
D.2.3 总25(OH)D标准品、质控品。
10.3 D.3 分析步骤
D.3.1 按血清(血浆)25(OH)D酶联免疫试剂盒使用说明准备仪器、标准品、质控品、试剂等。
D.3.2 血清(血浆)标本应达到室温,混合均匀后进行测定,确保样品杯中无气泡。为了防止液体挥发影响结果,所有样品、标准品、质控品上机后都应在2小时内测定。
D.3.3 严格按仪器和试剂盒操作说明要求进行标准品、质控品及样品的测定,并读取、保存、计算检测结果。
10.4 D.4 质量控制
10.4.1 D.4.1 内部质控
实验室应制定测试结果质量控制程序,明确内部质量控制的内容、方式和要求。随同样品检测需测定质量控制样品,绘制质量控制图,观察测试工作的稳定性、系统偏差及趋势,及时发现异常现象并采取相应的改进措施。
10.4.2 D.4.2 外部质控
实验室应参加国内外实验室认可机构组织的能力验证活动,参加国际间、国内同行间的实验室比对试验。根据外部评审、能力验证、考核、比对等结果评估检验结果的质量并采取相应的改进措施。