3 基本信息
ICS 11.020
C 62
中华人民共和国卫生行业标准 WS/T 571—2017《裂头绦虫幼虫检测》(Detection of diphyllobothroid larvae)由中华人民共和国国家卫生和计划生育委员会2017年8月1日《关于发布〈钉螺调查〉等9项推荐性卫生行业标准的通告》(国卫通〔2017〕11号)发布,自2018年2月1日起实施。
4 发布通知
关于发布《钉螺调查》等9项推荐性卫生行业标准的通告
国卫通〔2017〕11号
现发布《钉螺调查》等9项推荐性卫生行业标准,其编号和名称如下:
上述标准自2018年2月1日起施行。
特此通告。
国家卫生计生委
2017年8月1日
5 前言
本标准依据GB/T 1.1—2009给出的规则起草。
本标准起草单位:中国疾病预防控制中心寄生虫病预防控制所、上海出入境检验检疫局、上海市疾病预防控制中心。
本标准起草人:陈韶红、李树清、张小萍、许学年、卢艳、蔡玉春、张永年、李浩、艾琳、郑彬。
6 标准正文
6.1 1 范围
本标准适用于各级疾病预防控制机构、医疗机构和食品检测机构对鱼、蛙和蛇中裂头绦虫幼虫的检测。
6.2 2 规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 18088 出入境动物检疫采样标准
6.3 3 术语和定义
下列术语和定义适用于本文件。
3.1
裂头蚴 plerocercoid larvae
裂头绦虫的幼虫,是假叶目(Pseudophyllidea)、裂头科(Diphyllobothriidae)绦虫第三期幼虫的总称(参见附录A)。
3.2
阔节裂头蚴 plerocercoid larvae of Dibothriocephalus latus或phyllobothrium latum
3.3
曼氏裂头蚴 plerocercoid larvae of Spirometra mansoni
6.4 4 仪器器材
4.1 生物显微镜。
4.2 体视显微镜。
4.3 PCR扩增仪。
4.4 电泳仪。
4.6 超净工作台。
4.7 高速离心机。
4.8 解剖用手术器械。
6.5 5 试剂材料
6.5.1 5.1 试剂
胃蛋白酶消化液;Tris-乙酸电泳缓冲液(TAE);琼脂糖凝胶;6×加样缓冲液;100~2000 bp DNA marker;灭菌双蒸馏水(ddH2O);70%乙醇(配制见附录B的B.1)。
6.5.2 5.2 引物
扩增裂头蚴核糖体DNA转录间隔区(ITS)引物序列;扩增裂头蚴细胞色素C氧化酶(Coxl)引物序列;阔节裂头蚴特异性引物序列及曼氏裂头蚴特异性引物序列(见附录B的B.2)。
6.5.3 5.3 阳性对照
阳性对照为裂头绦虫相应基因片段的阳性克隆质粒或裂头蚴、裂头绦虫全基因组DNA。
6.6 6 检测步骤
6.6.1 6.1 样品准备
6.1.1 样品种类:海鱼、淡水鱼、蛙和蛇。
6.6.2 6.2 样品检测
6.6.2.1 6.2.1 压片检查法
用手术剪对受检的鱼、蛙和蛇逐条/只进行解剖。取出内脏,将腹腔壁内膜刮下,观察腹腔内壁表面,若有可疑白色点状物,用手术剪或手术刀分离皮肉,用两把小镊子将肌肉撕开,取含有白色点状物的组织用载玻片压片,用生物显微镜镜检判定结果。
6.6.2.2 6.2.2 蛋白酶消化法
称取样品250 g并剪成小块,按样品与胃蛋白酶消化液1:5的比例加入消化液,37℃消化至无肉眼可见的肉组织为止。消化后用0.8mm×0.8mm(10目)网筛过滤,滤液置于尖底量筒内,加水(用水参照GB/T 66828)至最大刻度处,沉淀洗涤至水清,全部沉渣置平皿,用体视显微镜镜检判定结果。
6.6.2.3 6.2.3 核酸检测法
6.6.2.3.1 6.2.3.1 取样
在体视显微镜下挑取虫体,初步鉴定后备用。PCR反应设立阳性对照,对照为裂头绦虫相应基因片段的阳性克隆质粒或裂头蚴、裂头绦虫全基因组DNA。无菌水作空白对照。
6.6.2.3.2 6.2.3.2 DNA的提取
(见附录B的B.3)
6.6.2.3.3 6.2.3.3 反应体系
总体积为25μL,模板DNA 2μL,上下游引物(10Lmol/L)各0.5μL,dNTPs 2μL,MgCl22.5μL,10xBuffer 2.5μL,Taq酶(5 U/μL) 0.2μL,补充ddH2O至25μL。
6.6.2.3.4 6.2.3.4 PCR反应程序
94℃预变性3 min; 94℃变性30 s,55℃退火30 s,72℃延伸1 min,35个循环;72℃延伸7 min。
6.6.2.3.5 6.2.3.5 电泳
取10μL产物与2μL的6×加样缓冲液混合,加样于含溴化乙锭的1.5%琼脂糖凝胶中。在1×TAE缓冲液中,3 V/cm~4 V/cm电泳约30 min,当溴酚蓝到达底部时停止电泳,用凝胶成像系统分析。
6.6.3 6.3 结果判定
6.6.3.1 6.3.1 裂头属的裂头蚴判定
若从鱼体内检出的幼虫大小若长2mm~20 mm,宽2mm~3 mm,乳白色,头节呈匙形,其背腹面各有一条窄而深凹的吸槽,体前端有凹陷且稍大,体不分节但具有横皱褶,尾部细,呈棍棒状,具有与成虫相似的头节,可初步判定裂头属的裂头蚴(参见附录C)。
6.6.3.2 6.3.2 迭宫属的裂头蚴形态判定
若从蛙或蛇体内检出的幼虫大小若长0.5cm~80 cm,宽0.3cm~1 cm,长带形,乳白色或淡黄色,虫体前端无吸槽,顶端中央有一孔向内凹陷成隧道状,并向后延伸形成盲管,虫体不分节,具有不规则的皱褶,可初步判定为迭宫属的裂头蚴(参见附录C)。
6.6.3.3 6.3.3 核酸扩增结果判定
6.3.3.1 目的基因扩增片段出现条带而空白对照未出现条带,实验结果成立。
6.3.3.2 阔节裂头蚴特异引物扩增,出现428 bp的特征条带,初步判定该虫种为阔节裂头蚴。
7 附录
7.1 附录A(资料性附录)病原学资料
裂头蚴(plerocercoid)是假叶目(Pseudophyllidea)、裂头科(Diphyllobothriidae)绦虫的第三期幼虫的总称。裂头科中的裂头属(Dibothriocephalus)又名双叶槽属(Diphyllobothrium)及迭宫属(Spirometra)的裂头蚴可感染人体。
7.1.1 A.1 形态
7.1.1.1 A.1.1 裂头属的裂头蚴的形态
阔节裂头蚴长2 mm~20 mm,宽2mm~3 mm,乳白色,头节呈匙形,其背腹面各有一条窄而深凹的吸槽,体前端有凹陷且稍大,体不分节但具有横皱褶,尾部细,呈棍棒状,具有与成虫相似的头节,裂头蚴皮层表面覆盖微毛,长度约1.5μm。
7.1.1.2 A.1.2 迭宫属的裂头蚴形态
曼氏裂头蚴长0.5cm~80 cm,宽0.3cm~1 cm,长带形,乳白色或淡黄色,虫体前端无吸槽,顶端中央有一孔向内凹陷成隧道状,并向后延伸形成盲管,虫体不分节,具有不规则的皱褶。
7.1.2 A.2 生活史
阔节裂头绦虫成虫寄生在人以及犬、猫、猪等动物的小肠内。虫卵随宿主粪便排出后,在15~25℃的水中,经过7d~15d的发育,孵出钩球蚴。当钩球蚴被剑水蚤吞食后,在其血腔内经过2周~3周的发育成原尾蚴。当受感染的剑水蚤被小鱼或幼鱼吞食后,原尾蚴可在鱼的肌肉、性腺、卵内发育为裂头蚴,裂头蚴并可随着鱼卵排出。当大鱼吞食含有裂头蚴的小鱼或鱼卵后,裂头蚴可侵入大鱼的肌肉组织内继续生存,直到终宿主食入带裂头蚴的鱼时,裂头蚴方能在其肠内经5周~6周发育为成虫。成虫在终宿主体内可活5年~13年。可感染阔节裂头蚴的第二中间宿主有:白斑狗鱼(Esox lucius)、江鳕(Lota lota)、河鲈(Perca fluviatilis)、三刺鱼(Gasterosteus aculeatus)、樱花钩吻鲑(Oncorhynchus masou)、鮻鱼(Liza haematocheila)、溪红点鲑(Salvelinus fontinalis)、虹鳟鱼(Oncorhynchus mykiss)、雅罗鱼属鲤(Leuciscus rutilus)、八目鳗(Lampetra japonicum)等。
曼氏迭宫绦虫的成虫寄生在猫、犬及食肉野生动物为终宿主的小肠内,虫卵随宿主粪便排出体外,在适宜温度下,经过2周~5周发育孵出六钩蚴,被剑水蚤吞食后发育成原尾蚴,原尾蚴被蛙类吞食可发育成裂头蚴,人吞食含有裂头蚴的第二中间宿主可引起曼氏裂头蚴病。可感染曼氏裂头蚴的第二中间宿主为蛙类;鸟类、蛇类、猪可作为转续宿主。
7.2 附录B(规范性附录)与检测相关的技术方法
7.2.1 B.1 试剂配制
胃蛋白酶2g,浓盐酸0.7 mL,加蒸馏水至100 mL,现用现配。
三羟甲基氨基甲烷(Tris碱)242 g,冰乙酸57.1 mL,pH 8.0的0.5 mol/L EDTA液100 mL,加蒸馏水定容至1000 mL,制成50xTAE缓冲液,混匀4℃保存备用。临用前50倍稀释。
B.1.3 1×TAE使用液
50×TAE 20 mL,加蒸馏水定容至1000 mL,混匀备用。
B.1.4 10 mg/mL溴化乙锭液
溴化乙锭1g,加蒸馏水定容至100 mL,磁力搅拌至完全溶解,室温避光保存。
琼脂糖1.5 g,加1xTAE定容至100 mL,完全融化后,溶液冷却至60℃,加10 mg/mL溴化乙锭5μL(终浓度0.5μg/mL),轻轻混匀后,制备凝胶。
B.1.6 6×加样缓冲液
溴酚蓝0.25 g,蔗糖40 g,加蒸馏水至100 mL。置4℃保存备用。
B.1.7 商品化试剂盒
Taq酶、dNTP等核酸提取及PCR试剂可选用商品化试剂和试剂盒。
7.2.2 B.2 引物模板
相关引物
引物名称 | 引物编号 | 序列 | 片段大小/bp |
裂头蚴ITS通用引物 | 18S-DF1 | 5'-ACTTGATCATTTAGAGGAAGT-3' | 1409 |
28S-DR4 | 5'-CTCCGCTTAGTGATATGCT-3' | ||
裂头蚴Cox1通用引物 | JB6 | 5'-GATAGTAAGGGTGTTGA-3' | 650 |
JB5R | 5 '-CAAGTATCRTGCAAAATATTATCAAG-3' | ||
阔节裂头蚴特异引物 | Dl/Dn-1805F | 5'-CAGTGGGAATGGTGCTTGTAATGT-3' | 428 |
Dl-2211R | 5'-TAACCTTTACTTATAACTACT-3' | ||
F965 | 5 '-CTTGGCTTTATATGATTTAAATAG-3' | 156 | |
R1120 | 5'-GTTTGGTGCACAGTACGTTTTAAAA-3' |
7.2.3 B.3 DNA的提取
B.3.1 挑取单条待鉴定虫体放入灭菌离心管,加入灭菌蒸馏水,半小时换一次水,重复洗涤3次,洗涤完毕后弃掉离心管中蒸馏水,用碾磨棒将离心管中虫体碾碎,加入180μL Buffer ATL,20μL蛋白酶K,混匀后于56℃孵育1~3 h至消化完全,期间不时振荡摇晃。
B.3.2 消化完全后,漩涡震荡15 s,加200μl Buffer AL,立即漩涡振荡混匀,再加入200μl乙醇(96~100%),漩涡振荡混匀。
B.3.3 离心柱置于收集管上,将上一步的混合物吸入离心柱中,8000 r/min离心1 min,弃收集管。
B.3.4 将离心柱置于新的收集管中,加500 μl Buffer AW1,8000 r/min离心1 min,弃收集管。
B.3.5 将离心柱置于新的收集管中,加500 μl Buffer AW2,14000 r/min离心3 min,弃收集管。
B.3.6 将离心柱置于灭菌的1.5 ml离心管中,加入200 μl Buffer AE室温孵育1 min,8000 r/min离心1min,离心所得DNA于-20℃冰箱保存备用(重复该步骤可扩大DNA回收率)。
7.2.4 B.4 实验试剂代码解释(试剂盒自带)
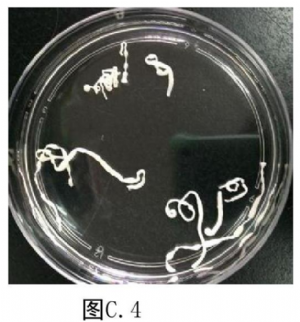
7.3 附录C(资料性附录)裂头蚴实物图
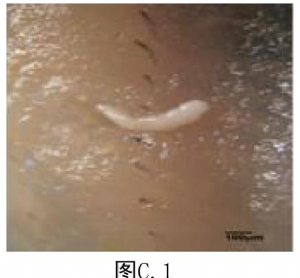
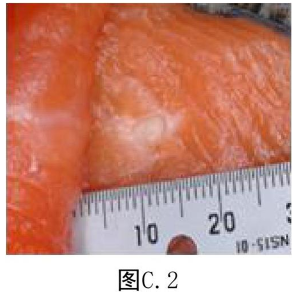
C.3 蛙体内的曼氏裂头蚴见图C.3

注:图C.1来自参考自文献:Tomàš Scholz, Hector H.Garcia, Roman Kuchta, Barbara Wicht. Update on the Human Broad Tapeworm (Genus Diphyllobothrium), Including Clinical Relevance. [J] Clin Microbiol Rev.2009 January; 22 (1):146-160. doi: 10.1128/CMR.00033-08
8 参考文献
[1] 吴观陵,人体寄生虫学,第4版,北京:人民卫生出版社,2013.
[2] Scholz T,Garcia HH, Kuchta R,Wicht B.Update on the human broad tapeworm (genus diphyllobothrium), including clinical relevance. Clin Microbiol Rev.2009,22(1):146-160.
[3] 余森海,许隆祺,人体寄生虫学彩色图谱,第1版,北京:中国科学技术出版社,1992.
[4] 刘自逵,刘国华,戴荣四,刘伟,李芬,等,湖南省猬迭宫绦虫的线粒体cox1和nad1基因的序列测
定及种系发育分析,畜牧兽医学报.2010,41: 463-468.
[5] Wicht B,Ruggeri-Bernardi N, Yanagida T,Nakao M, Peduzzi R,et al. Inter-and intra-specific characterization of tapeworms of the genus Diphyllobothrium (Cestoda: Diphyllobothriidea) from Switzerland, using nuclear and mitochondrial DNA targets. Parasitol Int.2010,59:35-39.
[6] SH Chen, L Ai, YN Zhang, JX Chen, WZ Zhang, et al. Molecular Detection of Diphyllobothrium nihonkaiense in Humans, China. Emerg Infect Dis,2014,20:315-318.