3 磷酸哌喹片药典标准
3.1 品名
3.1.1 中文名
3.1.2 汉语拼音
Linsuan Paikui Pian
3.1.3 英文名
Piperaquine Phosphate Tablets
3.2 含量或效价规定
本品含磷酸哌喹(C29H32Cl2N6·4H3PO4),应为标示量的93.0%~107.0%[1]。
3.3 性状
本品为糖衣片,除去糖衣后显白色至淡黄色[1]。
3.4 鉴别
(1)取本品的细粉适量(约相当于磷酸哌喹0.1g),加水5ml,加热使磷酸哌喹溶解,滤过,取滤液,分为两等份:一份中加硫氰酸铵试液数滴,即生成白色沉淀;另一份中加重铬酸钾试液数滴,即生成黄色沉淀。
(2)取本品的细粉适量(约相当于磷酸哌喹0.lg),加水5ml,加热使磷酸哌喹溶解,滤过,取滤液,加氨试液使溶液呈碱性,搅拌,滤过,滤液加硝酸溶液(1→2)使溶液呈酸性,加钼酸铵试液1ml,加热,即生成黄色沉淀;滤过,沉淀能在氨试液中溶解。[1]
(3)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(4)取本品除去糖衣后,研细,取细粉适量(约相当于磷酸哌喹0.1g),加水50ml,超声使溶解,滤过,取滤液,置250ml分液漏斗中,加氢氧化钠试液2ml,摇匀,加二氯甲烷50ml充分振摇,静置后取二氯甲烷层,置水浴上蒸干,取残渣,照红外分光光度法(2010年版药典二部附录Ⅳ C)测定,本品的红外光吸收图谱应与同法处理的磷酸哌喹对照品的图谱一致。[1]
3.5 检查
3.5.1 有关物质
避光操作。精密称取含量测定项下细粉适量(约相当于磷酸哌喹25mg),置50ml量瓶中,加流动相适量振摇使溶解,用流动相稀释至刻度,摇匀,滤过,取续滤液作为供试品溶液;精密量取1ml,置100ml量瓶中,用流动相稀释至刻度,摇匀,作为对照溶液;精密量取对照溶液1ml,置20ml量瓶中,用流动相稀释至刻度,摇匀,作为灵敏度试验溶液。取杂质Ⅰ、杂质Ⅱ和杂质Ⅲ对照品各约25mg,精密称定,分别置50ml量瓶中,杂质Ⅰ加流动相溶解并稀释至刻度,摇匀,作为杂质Ⅰ对照品贮备液,杂质Ⅱ与杂质Ⅲ分别加甲醇10ml溶解后,用流动相稀释至刻度,摇匀,作为杂质Ⅱ与杂质Ⅲ对照品贮备液。分别精密量取杂质Ⅰ对照品贮备液、杂质Ⅱ与杂质Ⅲ对照品贮备液各1ml,置同一200ml量瓶中,用流动相稀释至刻度,摇匀,作为对照品溶液。照含量测定项下的色谱条件,杂质Ⅱ检测波长为317nm,磷酸哌喹、杂质Ⅰ、杂质Ⅲ及其他未知杂质检测波长均为349nm,取灵敏度试验溶液20μl,注入液相色谱仪,以349nm为检测波长,记录色谱图,磷酸哌喹色谱峰信噪比不小于10;再精密量取供试品溶液、对照品溶液和对照溶液各20μl,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的4倍,供试品溶液色谱图中如有与杂质Ⅰ、杂质Ⅱ或杂质Ⅲ保留时间一致的色谱峰,分别按外标法以峰面积计算,均不得过磷酸哌喹标示量的0.5%,其他单个杂质峰面积不得大于对照溶液的主峰面积(1.0%),各杂质峰面积的和不得大于对照溶液主峰面积的2.5倍(2.5%)。供试品溶液色谱图中任何小于灵敏度试验溶液主峰面积的峰忽略不计。
3.5.2 溶出度
取本品,照溶出度测定法(2010年版药典二部附录Ⅹ C第二法),以0.1mol/L盐酸溶液1000ml为溶出介质,转速为每分钟75转,依法操作,经45分钟时,取溶液适量,滤过,精密量取续滤液2ml,置50ml量瓶中,用0.1mol/L盐酸溶液稀释至刻度,摇匀,照紫外-可见分光光度法(2010年版药典二部附录Ⅳ A),在240nm的波长处测定吸光度。另取磷酸哌喹对照品适量,精密称定,加0.1mol/L盐酸溶液溶解并定量稀释制成每1ml中约含10μg的溶液,同法测定,计算每片的溶出量。限度为标示量的80%,应符合规定。[1]
3.5.3 其他
应符合片剂项下有关的各项规定(2010年版药典二部附录Ⅰ A)。
3.6 含量测定
照高效液相色谱法(2010年版药典二部附录Ⅴ D)测定。
3.6.1 色谱条件与系统适用性试验
用十八烷基硅烷键合硅胶为填充剂(推荐色谱柱为:Lichrospher C18 250mm×4.6mm,5μm或效能相当的色谱柱);以乙腈-0.1%三氯乙酸溶液(用磷酸调节pH值至2.1土0.05)(25:75)为流动相;检测波长为349nm。取磷酸哌喹对照品与杂质I对照品各适量,加流动相溶解并稀释制成每1ml中分别含0.5mg与0.05mg的溶液,作为系统适用性溶液。取20μl注入液相色谱仪,记录色谱图,理论板数按磷酸哌喹峰计算不低于3000,磷酸哌喹峰与杂质I峰的分离度应大于14。
3.6.2 测定法
取本品10片,除去糖衣后,精密称定,研细,精密称取细粉适量(约相当于磷酸哌喹25mg),置50ml量瓶中,加流动相适量振摇使溶解,用流动相稀释至刻度,摇匀,滤过,精密量取续滤液5ml,置50ml量瓶中,用流动相稀释至刻度,摇匀,精密量取20μl,注入液相色谱仪,记录色谱图;另取磷酸哌喹对照品适量,精密称定,加流动相溶解并定量稀释制成每1ml中约含0.05mg的溶液,同法测定,按外标法以峰面积计算供试品中的C29H32Cl2N6.4H3PO4含量。[1]
3.7 类别
抗疟药。
3.8 规格
以C29H32Cl2N6·4H3PO4计 0.25g
3.9 贮藏
3.10 附
3.10.1 1.杂质Ⅰ
7-Chloro-4-(l-piperazinyl) quinoline
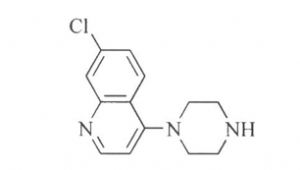
C13H14ClN3 247.72
3.10.2 2.杂质Ⅱ
7-Chloro-4-hydroxy-quinoline
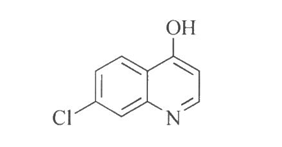
C9H6ClNO 179.60
3.10.3 3.杂质Ⅲ
1,4-Di(7-chloroquinoline-4-yl) piperazine
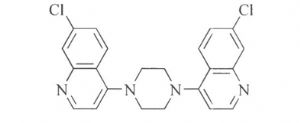
3.11 版本
《中华人民共和国药典》2010年版
4 参考资料
- ^ [1] 国家药典委员会.中华人民共和国药典:2010年版:第三增补本[M].北京:中国医药科技出版社,2010.