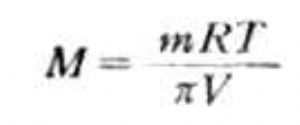2 注解
范特荷甫定律渗透压公式是1886年范特荷甫(van’t Hoff)根据实验数据得出一条规律:对稀溶液来说,渗透压与溶液的浓度和温度成正比,它的比例常数就是气体状态方程式中的常数R。这条规律称为范特荷甫定律。用方程式表示如下:
πV=nRT
或π=cRT
式中π为稀溶液的渗透压,V为溶液的体积,c为溶液的浓度,R为气体常数,n为溶质的物质的量,T为绝对温度。
上式称为范特荷甫公式,也叫渗透压公式。常数R的数值与π和V的单位有关,当π的单位为kPa,V的单位为升(L)时,R值为8.31kPa•L•K-1•mol-1。
范特荷甫公式表示,在一定温度下,溶液的渗透压与单位体积溶液中所含溶质的粒子数(分子数或离子数)成正比,而与溶质的本性无关。
π=mBRT
对于相同cB的非电解质溶液,在一定温度下,因为单位体积溶液中所含溶质的粒子(分子)数目相等,所以渗透压是相同的。如0.3mol•L-1葡萄糖溶液与0.3mol•L-1蔗糖溶液的渗透压相同。但是,相同cB的电解质溶液和非电解质溶液的渗透压则不相同。例如,0.3mol.L-1NaCl溶液的渗透压约为0.3mol.L-1葡萄糖溶液渗透压的2倍。这是由于在NaCl溶液中,每个NaCl粒子可以离解成1个Na和1个Cl-。而葡萄糖溶液是非电解质溶液,所以0.3mol•L-1NaCl溶液的渗透压约为0.3 mol•L-1葡萄糖溶液的2倍。
由此可见,渗透压公式中,对电解质溶液来说,浓度cB(或mB)是1升溶液中能产生渗透效应的溶质分子与离子总物质的量,称为渗透物质的量浓度。
通过测定溶液的渗透压,可以计算溶质的相对分子质量。如果溶质的质量为m,摩尔质量为M。实验测得溶液的渗透压为π,则该溶质的相对分子质量(数值等于摩尔质量)可通过下式求得: