4 血浆18-羟-皮质酮的医学检查
4.1 检查名称
4.2 分类
4.3 取材
4.4 血浆18-羟-皮质酮的测定原理
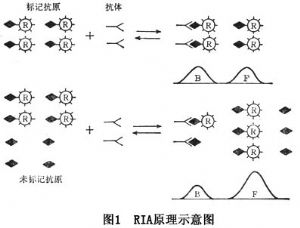
本法是标记抗原(Ag·)和非标记抗原(Ag)对特异性抗体(Ab)的竞争抑制反应,其反应为Ag·+Ag+Ab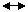 (Ag·Ab)+(AgAb)。当Ag·和Ab的量保持恒定,Ag与Ag·之和大于Ab上的有效结合点的数目,在该条件下,Ag与Ag·间存在着函数关系,亦即随着Ag浓度增加,Ag-Ab生成量多,而Ag·-Ab的数量则减少,游离的Ag·就增多。因为Ag·对Ab的结合,可因Ag竞争结合而遭抑制。反之,当Ag量少时,Ag-Ab生成量就少,Ag·-Ab量增多,而游离的Ag·减少(图1)。将结合的抗原抗体复合物(B)与游离抗原(F)分离,分别测定B和F的放射活性,计算出B/F或B/B+F值,可制出B/F或B/B+p对Ag量的关系曲线图。测定时,需用一系列已知浓度的Ag和一定量Ag·及相应抗体Ab混合,然后测出各标准浓度Ag参加下的Ag·-Ab放射结合率(B/B+F)或(B/F),绘出竞争抑制标准曲线(图2)。试验时,在同样条件下,根据被测Ag的放射性结合率,从标准曲线上查知相应Ag含量。
(Ag·Ab)+(AgAb)。当Ag·和Ab的量保持恒定,Ag与Ag·之和大于Ab上的有效结合点的数目,在该条件下,Ag与Ag·间存在着函数关系,亦即随着Ag浓度增加,Ag-Ab生成量多,而Ag·-Ab的数量则减少,游离的Ag·就增多。因为Ag·对Ab的结合,可因Ag竞争结合而遭抑制。反之,当Ag量少时,Ag-Ab生成量就少,Ag·-Ab量增多,而游离的Ag·减少(图1)。将结合的抗原抗体复合物(B)与游离抗原(F)分离,分别测定B和F的放射活性,计算出B/F或B/B+F值,可制出B/F或B/B+p对Ag量的关系曲线图。测定时,需用一系列已知浓度的Ag和一定量Ag·及相应抗体Ab混合,然后测出各标准浓度Ag参加下的Ag·-Ab放射结合率(B/B+F)或(B/F),绘出竞争抑制标准曲线(图2)。试验时,在同样条件下,根据被测Ag的放射性结合率,从标准曲线上查知相应Ag含量。
4.5 试剂
(1)抗原的纯化:试验需用高纯度的抗原。通常,蛋白质抗原的纯度应达到电泳分析纯,电泳后仅显示单一区带,并具有足够或完整的免疫原性。一般先经聚丙烯酰胺电泳鉴定,再用等电聚焦SDS聚丙烯酰胺双相电泳鉴定为单一区带,然后用于免疫动物和核素标记。
纯抗原因其溶液中缺乏其他蛋白质作稳定剂,或因贮存在纯离子浓度的缓冲液中,故易形成聚合物,因此在纯化抗原时需加注意。若采用聚合物抗原的标记,用于RIA中将会显著增加非特异性结合,降低测定的灵敏度。
(2)抗原的标记方法:标记用的核素有γ射线和β射线两大类。前者常用131I、125I、51Cr,后者多用3H、32P和14C。选择放射性核素首先要考虑比放射性,比放射性愈高,参与反应的抗原化学量就愈小,测定方法的灵敏度相对就愈高。核放射性和半衰期要适宜,便于使用和防护。标记后的抗原要保持其免疫原性。标记技术要简便、经济。
标记方法有直接标记和间接标记两大类,以最常用的125I为例分述如下。
①直接标记:将125I直接结合于蛋白质侧链残基的酪氨酸上,步骤单一,操作简便,标记物的比放射性较高,但此法仅能用于标记含酪氨酸的化合物,如所含的酪氨酸残基为蛋白质的特异性和生物活性所必需,则该活性易因标记而失活。
最常用的直接标记法为氯胺T标记法(简称h-T):氯胺T是对甲基苯磺基酰胺的N氯衍生物的钠盐,在水溶液中分解形成次氯酸成为一种氧化剂。在偏碱溶液中(pH值7.5)能使带负电荷的125I离子(Na-125I)氧化成带正电荷的125I离子,借以取代蛋白质酪氨酸苯环的氢,形成二碘酪氨酸。
125I标记率的高低与抗原(蛋白质或多肽)分子中酪氨酸的含量及其在分子中的暴露程度有关。
标记方法的原则是将纯化抗原和125I加入小试管底部,继将配制的氯胺T快速冲入,混匀振荡1~2min后加入偏重亚硫酸钠终止反应。再加碘化钾溶液稀释,然后在葡聚糖G50柱上分离,分别用井型闪烁计数器测定放射性强度(脉冲数/min、cpm),前部为标记抗原峰,后部为游离125I峰。在标记抗原峰试管中加等量1%白蛋白作为稳定剂即为标记抗原液。
②间接标记:是先将125I标记在载体上,纯化后再与蛋白质或肽抗原结合,用N琥珀酰亚胺-3-[4-羟5-(125I)碘苯]丙酸盐(NSHPP)作为间接标记试剂,该试剂的N琥珀酰亚胺基与多肽游离氨基缩合为结合物,使125I标记的苯基与蛋白质的氨基结合。
本法先以氯胺T使125I接上NSHPP,由于在水溶液中它迅速水解为3-(4-羟苯基)丙酸,故在碘化反应中要尽快减少这种水解作用。这种碘标记物必须从水箱抽提到有机溶液中去,再除去有机溶剂后,使125I-NSHPP与蛋白质结合,制成125I-NSHPP-蛋白质标记物。
本法可标记缺乏酪氨酸残基的多肽,其最大优点是不损伤蛋白质的活性,能保存标记物高度的酶活性或免疫活性,适合于对不稳定的蛋白质标记,缺点是操作复杂,标记率低。
(3)标记抗原的鉴定:为保证放射免疫测定的质量,制备的标记物必需作如下鉴定:
游离放射性碘的含量 用三氯乙酸将所有蛋白质沉淀,分别测定沉淀物和上清液的cpm值。一般要求游离碘占总放射性碘的5%以下。标记抗原贮存过久时,可出现标记物的解离,一旦超过5%则应废弃。
免疫活性 用小量标记抗原加过量抗体,反应后分离B和F,分别测定其放射性,算出百分结合率,此值应在80%以上,值越大,表示损伤抗原越少。
放射强度 它是指单位重量抗原的放射强度,比放射性越高,测定越敏感。标记抗原的比放射性以125I的标记率或利用率表示。


(4)抗体的制备和鉴定 RIA中所用的抗体应具有高亲和力和高特异性,制备高价单相抗血清,最好以标记用的纯化抗原免疫动物,制备半抗原的抗血清,需先将半抗原与载体结合,使成免疫原,常用的载体为牛血清白蛋白。
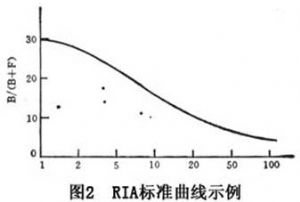
抗血清同样也要加以严格鉴定,包括其灵敏度、亲和力和特异性。在固定量标记抗原与不同浓度的抗血清作用的条件下,测定B/F值,制得一条B/F值对不同稀释度抗血清的曲线图(图3),该曲线的直线部分上段的斜率是抗体最大亲和力的定性标志,也是灵敏度的标志。斜率越大,RIA灵敏度越高,在许多RIA反应系统中,呈最大灵敏度的抗体浓度为B/F=1。
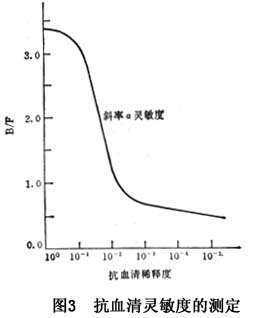
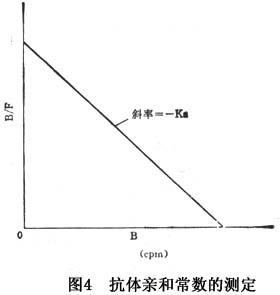
当采用固定量的抗体(Q0)与不同浓度的抗原作用时,以B/F对B作图,所得曲线的斜率就是亲和常数(Ka)的负数(图4)。
在RIA反应系统中,测定结构相似的不同物质时,可以鉴定抗体的特异性。
4.6 操作方法
(1)抗原与抗体反应:将标本(非标记抗原)、标记抗原和抗血清顺序定量加入小试管内,置室温(15~30℃)作用24h,使其充分竞争结合。
(2)B、F分离:分离技术多种多样,常用沉淀法。①第二抗体沉淀法:又称双抗体法,在受检抗原与第一抗体特异性反应后加入相应的第二抗体,使形成的抗原-第一抗体-第二抗体的复合物共沉,一经离心即可使结合标记抗原B与游离抗原F分离。本法是特异性沉淀,分离完全,非特异性结合力低。但第二抗体用量较大,成本较高。此外血清浓度、抗凝剂的有无因素可在一定程度上影响结果。②聚乙二醇(PEG)沉淀法:使蛋白质处于等电点状态,水化层破坏而导致蛋白质沉淀。本法优点是PEG制备方便、价廉、分离快速,缺点是非特异沉淀物较多,分离不完全。③第二抗体-聚乙二醇沉淀法:本法既有PEG法的快速沉淀优点,且保持第二抗体特异性沉淀的作用,又减少第二抗体用量,并降低PEG浓度,使非特异沉淀物减少。④活性炭吸附法:利用活性炭表面活性将小分子的游离部分吸附。如在活性炭表面涂上一层葡聚糖,使它表面具有一定孔径的网眼,从而允许小分子游离抗原或半抗原逸入而被吸附,而大分子复合物则被排斥在外。在抗原与抗体反应后,加入葡聚糖-活性炭,放置5~10min,使游离抗原吸附在活性炭颗粒上,离心使颗粒沉淀,上清液中含有结合的标记抗原。
(3)放射性强度测定:B和F分离后,即可测定其放射性强度。测量仪器有两类:液体闪烁计数仪(测β射线)和晶体闪烁计数仪(测γ射线)。计数单位是探测器输出的电脉冲数,单位为cpm(脉冲数/min)。
每次测定均需作一标准曲线图,以标准抗原的不同浓度为横坐标,以测到的相应放射性强度为纵坐标作图。放射性强度可任选B或F,亦可采用计算值B/B+F、B/F或B/B0。标本应作双份测定,取其平均值,在标准曲线上查出相应的受检抗原浓度。
4.7 正常值
放射免疫法:
立位:132~318ng/L
卧位(30min):61~137ng/L
4.8 化验结果临床意义
(1)腺瘤型原发性醛固酮增多症的18-OH-B浓度升高较增生型原发性醛固酮明显。
(2)上午立位4h,明显降低者为腺瘤型原发性醛固酮增多症;明显升高者为增生型原发性醛固酮增多症。
4.9 附注
(1)标本留取同血清皮质醇。但饮食要控制钠和钾,标准饮食为:钠100mmol/d,钾60~100mmol/d。
(2)服用某些药物可影响醛固酮测定结果,如口服避孕药、雌激素类、呋塞米、血管紧张素等药可使测定结果偏高;服用利舍平、脱氢皮质酮、普萘洛尔、甲基多巴及使用肝素等,可使测定结果降低。
(3)限制钠、钾的饮食可使测定结果偏高。