基本信息
ICS 11.020
C62
中华人民共和国卫生行业标准 WS/T 569—2017《疟原虫检测血涂片镜检法》(Microscopic exarmnation ofblood films for malaria parasites)由中华人民共和国国家卫生和计划生育委员会2017年8月1日《关于发布〈钉螺调查〉等9项推荐性卫生行业标准的通告》(国卫通〔2017〕11号)发布,自2018年2月1日起实施。
发布通知
关于发布《钉螺调查》等9项推荐性卫生行业标准的通告
国卫通〔2017〕11号
现发布《钉螺调查》等9项推荐性卫生行业标准,其编号和名称如下:
WST 563—2017 钉螺调查
WST 564—2017 巴贝虫病诊断
WST 565—2017 蛔虫病诊断
WST 566—2017 片形吸虫病诊断
WST 567—2017 阴道毛滴虫病诊断
WST 568—2017 阿米巴病肠外脓肿诊断
WST 569—2017 疟原虫检测 血涂片镜检法
WST 570—2017 肠道蠕虫检测 改良加藤厚涂片法
WST 571—2017 裂头绦虫幼虫检测
上述标准自2018年2月1日起施行。
特此通告。
国家卫生计生委
2017年8月1日
前言
本标准按照GB/T 1.1—2009给出的规则起草。
本标准起草单位:海南省疾病预防控制中心、江苏省寄生虫病防治研究所、中国疾病预防控制中心寄生虫病预防控制所、云南省寄生虫病防治所、海南省农垦总局医院。
本标准主要起草人:王善青、高琪、汤林华、杨恒林、郑彬、胡锡敏、王光泽、李雨春、刘莹、欧阳范献。
标准正文
疟原虫检测血涂片镜检法
1 范围
本标准规定了血涂片镜检法检测疟原虫的技术规范。
本标准适用于各级疾病预防控制机构和医疗机构对疟原虫的显微镜检测。
2 术语和定义
下列术语和定义适用于本文件。
2.1
疟原虫 Plasmodium spp
疟原虫是一类单细胞、寄生性的真核动物,是疟疾(malaria)的病原体。寄生于人体的疟原虫主要有恶性疟原虫(Plasmodium falciparum)、间日疟原虫(Plasmodium vivax)、三日疟原虫(Plasmodium malariae)和卵形疟原虫(Plasmodium ovale)等。
2.2
血涂片 blood films
将血液涂制于载玻片上制成的涂片。供显微镜疟原虫检查用的血涂片包括厚血膜涂片和薄血膜涂片两种。
3 仪器和器材
3.1 生物显微镜(100×油浸物镜、5×或10×目镜)。
3.2 计数器。
3.3 载玻片(无划痕无油污的洁净载玻片)。
3.4 推片。
3.5 血片染色架。
3.6 血片干燥架。
3.7 玻片盒。
3.8 染色盘和染色缸。
4 试剂和材料
4.1 吉氏染色原液。
4.2 pH7.2磷酸盐缓冲液(PBS)。
4.3 甲醇(分析纯)。
4.4 香柏油或专用浸油(折射率≥1.5)。
4.5 二甲苯(分析纯)。
4.6 75%酒精。
4.7 一次性采血针。
4.8 一次性手套。
5 检测步骤
5.1 血涂片的制作
5.1.1 采血部位及取血方法
经75%乙醇消毒采血部位,待干后,用一次性采血针在耳垂或指端扎刺取血,婴儿可从拇趾或足跟扎刺取血。取1张己消毒推片,用拇指和食指夹持推片侧缘中部,用推片左下角刮取血液4μL~5μL用于制作厚血膜,再用该端中部刮取血液1μL~1.5μL用于制作薄血膜。
5.1.2 厚血膜制作
取1张载玻片,将推片左下角的血滴涂于载玻片的中央偏左,由里向外划圈涂成直径0.8cm~1.0cm的圆形厚血膜,厚度以1个油镜视野内可见到5个~10个白细胞为宜。
5.1.3 薄血膜制作
用干棉球抹净推片左下角上的血渍,然后将推片下缘平抵载玻片的中线,当血液在载玻片与推片之间向两侧扩展至约2cm宽时,使2张玻片保持25°~35°,从右向左迅速向前推成舌状薄血膜。每张载玻片上1个厚血膜和1个薄血膜(参见附录A)。
5.1.4 编号
血膜制好后水平放置,充分干燥后,用铅笔在玻片一侧毛玻璃上或在薄血膜上编号。
5.2 固定与溶血
5.2.1 薄血膜固定
将薄血膜一端朝下呈45°,用棉签蘸取甲醇溶液,均匀轻抹于薄血膜表面,避免碰触厚血膜。
5.2.2 厚血膜溶血
在干燥的厚血膜上滴加蒸馏水数滴,完全覆盖血膜,溶血数分钟,待血膜呈浅灰色,倾去溶血液。厚血膜制作后1d内染色无需溶血,超过1d的应溶血。
5.3 吉氏染色
5.3.1 吉氏染液的配制(参见附录B)
吉氏染液包括吉氏染液原液和吉氏染液工作液。吉氏染液原液由5g吉氏粉加250mL甘油充分研磨后加入250mL甲醇配制。吉氏染液原液在避光条件下可长期保存。常用的吉氏染液工作液包括2%,3%和10%浓度三种,分别由吉氏染液原液和pH 7.2磷酸盐缓冲液(PBS)按比例配制。吉氏染液工作液只能使用时新鲜配制。
5.3.2 单张血涂片染色(参见附录C)
单张血涂片吉氏染色常用于临床疟疾患者的显微镜疟原虫检测。采用3%吉氏染液的常规染色方法血涂片染色质量较好,可长期保存,染色时间约30min。采用10%吉氏染液的快速染色方法染色时间较短,8 min~10min,但血涂片不适合长期保存。
5.3.3 成批血涂片染色(参见附录C)
成批血涂片吉氏染色常用于人群流行病学调查中的显微镜疟原虫检测,常采用2%吉氏染液进行批量血涂片染色。
5.4 镜检
5.4.1 显微镜检查
在染色后的血膜上加1滴香柏油或专用浸油,用100X油浸物镜、5×或10×目镜的光学显微镜检查。染色质量较好的血膜,红细胞呈淡红色,嗜酸性粒细胞颗粒呈鲜红色,嗜中性粒细胞核呈紫蓝色,淋巴细胞及疟原虫胞浆呈蓝色或淡蓝色,疟原虫核呈红色。除环状体外,其他各期均可查见疟色素。疟原虫检测以厚血膜为主,虫种鉴别以薄血膜为主。看片路线顺序为薄血膜从舌尖部分开始,厚血膜从上端或下端开始(参见附录D)。
5.4.2 结果判定
5.4.2.1 疟原虫检测阴性
厚血膜在油镜下,最少检查100个视野或整个厚血膜未查见疟原虫方可判为阴性。
5.4.2.2 疟原虫检测阳性
血膜中查到疟原虫判定为阳性,并根据疟原虫形态(参见附录E)确定恶性疟原虫、间日疟原虫、三日疟原虫、卵形疟原虫或混合感染。
5.4.3 疟原虫的计数
5.4.3.1 厚血膜的疟原虫计数法
镜检厚血膜,计数每个视野中的疟原虫数和白细胞数,计数200个白细胞以上,疟原虫密度很低时计数1000个。用下式算出疟原虫密度。疟原虫数÷白细胞数×每微升血中白细胞数=疟原虫数/微升血。如果无法进行白细胞计数,则以8000个白细胞/微升血计算。
5.4.3.2 薄血膜的疟原虫计数法
镜检薄血膜,计数每个视野中的疟原虫数和红细胞数,计数1000个红细胞以上。用下式算出疟原虫密度。疟原虫数÷红细胞数×每微升血中红细胞数=疟原虫数/微升血。如果无法进行红细胞计数,则以男性500万个/微升血、女性按450万个/微升血计算。薄血膜的疟原虫计数法适用于疟原虫密度很高时(每微升血中疟原虫数>16000个)的疟原虫计数。
5.5 血涂片保存
用吸水纸吸去已检血涂片血膜表面的香柏油或专用浸油,在血膜上滴加2滴~3滴二甲苯,然后用吸水纸吸干(专用浸油无需用二甲苯清洗,可直接用吸水纸吸干)。置血涂片于玻片盒内,避光、干燥和阴凉保存,以备复核。
附录
附录A(资料性附录)厚血膜和薄血膜血涂片制作示意图
厚血膜和薄血膜血涂片制作示意图见图A.1。
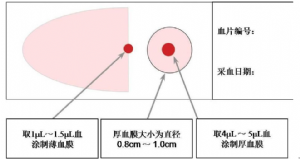
图A.1厚血膜和薄血膜血涂片制作示意图
附录B(资料性附录)吉氏染液的配制
B.1 吉氏染色原液配制
吉氏粉5.0g,甲醇250mL,甘油250mL。
将吉氏粉置于研钵中,加入少量甘油充分研磨,然后边加边磨,至甘油加完为止,倒入500mL有塞深色玻璃瓶中。在研钵中加入少量甲醇,洗掉剩余部分,倒入瓶内,再次加甲醇,洗后再倒入瓶中,至甲醇洗净研钵中甘油为止。塞紧瓶塞,置室温内,每天用力摇动溶液5min,3d后即可使用。
注意事项:将瓶塞塞紧,以避免蒸发和高湿造成的氧化;储存在深色的玻璃瓶中,避免阳光直射,储存时间越久染色效果越佳。根据日常的需求,用干燥吸管吸取少量的染色原液到密闭的分装瓶中(大约25mL)。切勿向原液中加入水。
B.2 pH 7.2磷酸盐缓冲液(PBS)的配制
先制备好两种贮备溶液。溶液Ⅰ为9.5g无水磷酸氢二钠加蒸馏水至1000mL,溶液Ⅱ为9.07g磷酸二氢钾加蒸馏水至1000 mL。制备时将磷酸盐置于容量瓶中,加入部分蒸馏水摇匀使溶解后,再加入蒸馏水稀释至1000 mL,充分摇匀,塞紧备用。临用时,取73 mL溶液Ⅰ和27 mL溶液Ⅱ,倒入1000 mL容量瓶中,加入部分蒸馏水,混合摇匀后,再加入蒸馏水稀释至lOOOmL的刻度,塞紧瓶塞反复摇匀后,即配制成pH7.2的缓冲溶液。
B.3 吉氏染色工作液的配制
B.3.1 3%吉氏染色工作液的配制
在97mLpH 7.2磷酸盐缓冲液中加入3 mL吉氏染色原液并混匀。
B.3.2 10%吉氏染色工作液的配制
在9mLpH 7.2磷酸盐缓冲液中加入1 mL吉氏染色原液并混匀。
B.3.3 2%吉氏染色工作液的配制
在98mLpH 7.2磷酸盐缓冲液中加入2 mL吉氏染色原液并混匀。
B.3.4 注意事项
吸取吉氏染色原液时切勿摇晃盛染色原液瓶子。吉氏染色工作液应现用现配,切勿将未用完的吉氏染色工作液倒回原液瓶中。
附录C(资料性附录)染色方法
C.1 单张血涂片染色法
C.1.1 3%吉氏染液染色法
C.1.1.1 把薄血膜经甲醇固定的血涂片血膜朝上水平放置在染色盘中。
C.1.1.2 用吸管吸取新配制的3%吉氏染液约3mL,滴加于厚、薄血膜上,至染液均匀覆盖血膜但不溢出为止。
C.1.1.3 静置染色约30min。
C.1.1.4 将染色盘移至冲水池,用缓慢流水沿血涂片上缘冲洗约Imin。
C.1.2 10%吉氏染液快速染色法
C.1.2.1 把薄血膜经甲醇固定的血涂片血膜朝上水平放置在染色盘上。
C.1.2.2 用吸管吸取新配制的10%吉氏染液约3mL,滴加于厚、薄血膜上,至染液均匀覆盖血膜但不溢出为止。
C.1.2.3 静置染色约8 min~10 min。
C.1.2.4 将染色盘移至冲水池,沿血涂片上缘用缓慢流水冲洗约1 min。
C.1.2.5 将染色后的血涂片血膜朝下插入血片干燥架,晾干。
C.2 成批血涂片染色法
C.2.1 将每张血涂片的血膜朝一个方向插入染色缸中,或将血涂片血膜朝外成对插入染色缸中。
C.2.2 倒入新配制的2%吉氏染液浸没厚、薄血膜。
C.2.3 静置染色约30 min。
C.2.4 向染色缸中注入自来水或PBS缓冲液至溢出,除去染液表面浮渣,将染色缸中残余的染液倾出,加入新水,缓慢冲洗2次~3次。
C.2.5 取出血涂片,血膜朝下插入血片干燥架,晾干。
C.3 注意事项
染色后不要直接将染液倒掉,应将血涂片连同染液一起放在水中漂洗,或沿玻片及染色缸边缘加水,使染液表层溢出,并轻轻冲洗,以免染液色素颗粒玷污血膜。成批染色时,不要将染液直接倒到厚血膜上,以免将厚血膜冲掉。染色时间除染液浓度外,还与染色时的温度有关,成批染色时,应先进行单张血涂片试染,以确定最佳染色时间。
附录D(资料性附录)看片路线顺序示意图
看片路线顺序示意图见图D.1。
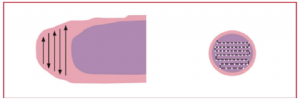
图D.1 看片路线顺序示意图
附录E(资料性附录)四种疟原虫薄、厚血膜形态(吉氏染色)
E.1 恶性疟原虫薄厚血膜形态图见图E.1。
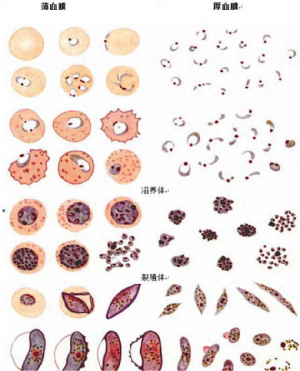
图E.1 恶性疟原虫薄厚血膜形态图
E.2 间日疟原虫薄、厚血膜形态图见图E.2。

图E.2 间日疟原虫薄、厚血膜形态图
E.3 三日疟原虫薄、厚血膜形态图见图E.3。
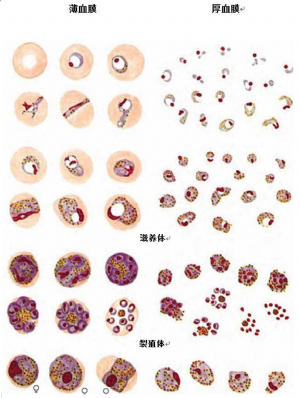
图E.3 三日疟原虫薄、厚血膜形态图
E.4 卵疟原虫薄、厚血膜形态图见图E.4。
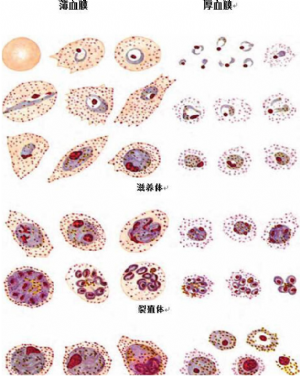
图E.4 卵疟原虫薄、厚血膜形态图
参考文献
[1] 卫生部疾病预防控制局 疟疾防治手册.北京:人民卫生出版社2006:179-185.
[2] WS 259—2015 疟疾的诊断
[3] 王鸿利,叶裕春 中华检验医学大辞典.上海:上海科学技术出版社 2000: 232.
[4]中国人民共和国卫生部医政司 全国临床检验操作规程(第三版) 2006: 242-243.
[5] Basic malaria microscopy Part 1 - 2nd edition. WHO,2010.
[6] Technical consultation to update the WHO malaria microscopy quality assurance manual.WHO.26-28 March 2014, Geneva, Switzerland Meeting Report, Global Malaria Program.
[7] Malaria Microscopy Quality Assurance Manual Version 1, WHO, February 2009
[8] Basic malaria microscopy,2nd edition.WHO,2010.
[9] Microscopy for the detection, identification and quantification of malaria parasites on stained thick and thin blood films in research settings. WHO/TDR,2015.