3 基本信息
ICS 11.020
C 59
中华人民共和国卫生行业标准 WS 296—2017《麻疹诊断》(Diagnosis for measles)由中华人民共和国国家卫生和计划生育委员会2017年07月24日《关于发布〈病原微生物实验室生物安全通用准则〉等5项卫生行业标准的通告》(国卫通〔2017〕7号)发布,自2018年02月01日起实施,代替WS 296—2008,WS 296—2008同时废止。
4 发布通知
关于发布《病原微生物实验室生物安全通用准则》等5项卫生行业标准的通告
国卫通〔2017〕7号
现发布《病原微生物实验室生物安全通用准则》等5项卫生行业标准,其编号和名称如下:
一、强制性卫生行业标准
WS 233—2017 病原微生物实验室生物安全通用准则(代替WS 233—2002);
WS 296—2017 麻疹诊断(代替WS 296—2008)。
二、推荐性卫生行业标准
WS/T 191—2017 软下疳诊断(代替WS 191—1999);
WS/T 236—2017 生殖器疱疹诊断(代替WS 236—2003);
上述标准自2018年2月1日起施行,WS 233—2002、WS 296—2008、WS 191—1999、WS 236—2003同时废止。
特此通告。
国家卫生计生委
2017年7月24日
5 前言
本标准第5章为强制性条款,其余为推荐性条款。
本标准按照GB/T 1.1—2009给出的规则起草。
本标准代替WS 296—2008《麻疹诊断标准》。本标准自实施之日起,WS 296—2008同时废止。
本标准与WS 296—2008相比,主要修改如下:
——修改了缩略语(见第2章,2008年版的第2章);
——修改了麻疹的诊断依据(见第3章,2008年版的第3章);
——修改了临床诊断病例的定义(见第5章,2008年版的第5章);
——增加了实验室检测方法的标准操作(见附录A和附录B,2008年版的附录A和附录B);
——增加了麻疹流行病学,尤其是新形势下麻疹传播呈现的流行病学特征、临床表现、并发症等内 容(见附录C,2008年版的附录C)。
本标准起草单位:中国疾病预防控制中心、中国疾病预防控制中心病毒病预防控制所、首都医科大学附属北京地坛医院、首都医科大学附属北京儿童医院、广东省疾病预防控制中心、浙江省疾病预防控制中心。
本标准主要起草人:罗会明、许文波、余文周、李兴旺、马超、张燕、谢正德、郝利新、郑慧贞、谢淑云、苏琪茹。
本标准所代替标准的历次版本发布情况为:
——GB 15983—1995;
——WS 296—2008。
6 标准正文
麻疹诊断
6.1 1 范围
本标准适用于全国各级各类医疗卫生机构及其医务人员对麻疹的诊断。
6.2 2 缩略语
下列缩略语适用于本文件。
CPE:致细胞病变效应(cytopathic effect)
DEPC:焦碳酸二乙酯(diethyl pyrocarbonate)
ELISA:酶联免疫吸附试验(enzyme-linked immunosorbent assay)
IgG:免疫球蛋白G(immunoglobulin G)
IgM:免疫球蛋白M(immunoglobulin M)
RF:类风湿因子(rheumatoid factor)
RNA:核糖核酸(ribonucleic acid)
RT-PCR:逆转录-聚合酶链反应(reverse tranion-polymerase chain reaction)
RPM:每分钟转数(revolutions per minute)
OD:光密度值(optical density value)
VTM:病毒运输液(virus transportation medium)
6.3 3 诊断依据
6.3.1 3.1 流行病学史
3.1.1 在出疹前7 d~21 d与麻疹确诊患者有接触史。
3.1.2 在出疹前7 d~21 d有麻疹流行地区居住或旅行史。
6.3.2 3.2 临床表现
3.2.2 在病程第3天~第4天开始出现红色斑丘疹,疹间皮肤正常。出疹顺序一般自耳后、面部开始,自上而下向全身扩展,并可累及黏膜。出疹时间一般持续3 d~5 d。
3.2.3 咳嗽、流涕、喷嚏等上呼吸道卡他症状,并有畏光、流泪、结膜炎症状。
3.2.4 起病早期(一般于病程第2天~第3天)在口腔颊黏膜见到麻疹黏膜斑(Koplik斑)。
6.3.3 3.3 实验室检测
3.3.1 采血前8 d~56 d内未接种过含麻疹成分减毒活疫苗,而出疹后28 d内血标本中麻疹IgM阳性(见附录A)。
3.3.2 咽拭子或尿液标本中麻疹病毒核酸阳性或分离到麻疹病毒(见附录B)。
3.3.3 恢复期血标本麻疹IgG抗体滴度比急性期有≥4倍升高,或急性期抗体阴性而恢复期抗体阳转(见附录A)。
6.4 4 诊断原则
6.5 5 诊断
6.5.1 5.1 疑似病例
具备3.2.1、3.2.2和3.2.3。
6.5.2 5.2 临床诊断病例
疑似病例符合以下任何一项者:
a) 具备3.1.1和/或3.1.2,且未明确诊断为其他疾病;
b) 具备3.2.4;
6.5.3 5.3 实验室确诊病例
疑似病例具备3.3.1、3.3.2、3.3.3中任何一项者。
6.5.4 5.4 排除病例
疑似病例符合以下任何一项者:
a) 出疹后4 d~28 d内采集的血标本检测麻疹IgM抗体阴性,且不符合3.1.1和/或3.1.2;
b) 出疹后3d内采集的血标本检测麻疹IgM抗体阴性,合格咽拭子/尿液标本中麻疹病毒核酸阴性,且不符合3.1.1和/或3.1.2;
d) 病原学标本分离鉴定出麻疹疫苗株病毒或疫苗株病毒核酸阳性,且未分离出麻疹野病毒也无麻 疹野病毒核酸阳性;或同时符合以下5种情形的:
3) 血标本采集日期为接种含麻疹成分减毒活疫苗后8 d~56 d,且检测麻疹IgM阳性;
4) 流行病学调查未发现该病例引起的续发病例;
5) 流行病学和实验室调查未发现其他可明确解释的原因。
6.6 6 鉴别诊断
7 附录
7.1 附录A(规范性附录)血清学诊断方法
7.1.1 A.1 血液标本的采集、储存及运输
7.1.1.1 A.1.1 血标本的采集
出疹后28 d内采集血液标本,用于麻疹IgM和IgG血清学检测。
7.1.1.2 A.1.2 在下列情况下需要采集第2份血标本
出疹后3d内采集的血标本检测麻疹IgM抗体阴性,无合格咽拭子/尿液标本,需要采集4 d~28 d的第2份血标本。
7.1.1.3 A.1.3 血标本采集流程
A.1.3.1 用无抗凝剂采血管收集2 mL~3 mL静脉血,在管壁上做好标记。
A.1.3.2 血标本不能冷冻,应1000 RPM离心10 min,用于分离血清;如果无离心机,血标本应冷藏4℃放置,直到血清完全析出。
A.1.3.3 小心吸取血清,避免吸到红血球,在无菌条件下,移至带外螺旋盖的血清管中,在管壁上做好标记。
A.1.3.4 填写标本送检表,包括最后一次接种含麻疹成分疫苗日期、出疹日期、标本采集日期。送检表上要注明病例编号。
7.1.1.4 A.1.4 血标本的储存
A.1.4.1 血标本应冷藏(2℃~8℃)保存,并在24h内送达检测实验室。如不能达到上述要求,应按照A.1.3方法分离血清。
A.1.4.2 无菌血清应在48 h内使用冰盒运送到检测实验室,或保存在2℃~8℃,最多不能超过7d。血清长期保存应在-20℃以下冷冻,避免反复冻融。
7.1.1.5 A.1.5 血标本的运输
标本应尽快运送到检测实验室,将盛装标本的容器放在有封口的塑料袋中,用冷藏盒或保温瓶运送,将标本送检单放在塑料袋中,再用胶带固定在冷藏盒中的上部,运输日期确定后,通知接收实验室标本运送的时间和运输方法。
7.1.2 A.2 实验室检测
7.1.2.1 A.2.1 ELISA法检测麻疹lgM抗体
7.1.2.1.1 A.2.1.1 用途
主要用于定性和/或定量检测人血清或血浆中抗麻疹病毒的IgM抗体,用于麻疹早期诊断。
7.1.2.1.2 A.2.1.2 操作步骤(或按照试剂使用说明书进行)
A.2.1.2.1 定量ELISA法检测麻疹病毒IgM抗体的标本稀释法
A.2.1.2.1.1 应使用500μL稀释缓冲液对10μL患者待测样品进行稀释,制成患者标本稀释液。
A.2.1.2.1.2 将40μL RF加入100μL患者标本稀释液(A.2.2.2.1.1)中,并用60μL稀释缓冲液进行稀释,最终标本稀释比例为1:100。
A.2.1.2.2 检测过程
A.2.1.2.2.1 将检测所需数目的微孔条放到微孔板框上并准备好一张标签。
A.2.1.2.2.2 加入RF的待测血清标本,于室温吸附15 min或4℃过夜。
A.2.1.2.2.3 在微量孔内分别加入100μL的已稀释样本或立即可用的对照血清。留一个孔作为底物空白,例如:
A.2.1.2.2.4 将样品于湿盒内(37±1)℃孵育(60±5)min。
A.2.1.2.2.5 孵育后以洗液缓冲液洗涤板孔(使用自动洗板机或手工洗板)。先吸去或甩去洗液;然后每孔内加入300μL洗液,再吸去或甩去洗液,重复洗涤过程共4次;最后将微孔板翻转过来在纸巾上拍干,使微孔中不再含有液体。
A.2.1.2.2.6 加入酶标记抗体:于相应孔内(底物空白孔除外)加入100μL IgM酶标记抗体,湿盒内(37±1)℃孵育(30±1)min。
A.2.1.2.2.7 以洗液缓冲液洗涤板孔(见A.2.2.2.2.5)。
A.2.1.2.2.8 加入底物:于每孔内加入100μL底物溶液(包括底物空白孔),湿盒内(37±1)℃孵育(30±1)min。
A.2.1.2.2.9 终止反应:每孔内加入100μL终止液,轻微振荡微孔板以混合溶液。
A.2.1.2.2.10 读取OD值:以底物空白孔为空白对照,60 min内读取OD值。
7.1.2.1.3 A.2.1.3 质量控制标准
A.2.1.3.1 底物空白孔的OD值必须<0.25。
A.2.1.3.3 标准血清的平均OD值必须在有效范围内,此范围已在试剂盒专用的质量控制证书中给定(减去底物空白之后)。
A.2.1.3.4 如果未达到以上标准,则试验无效且应重做。
7.1.2.1.4 A.2.1.4 结果评估
根据标准血清OD值计算CUT-OFF值上限和下限,标本OD值≥CUT-OFF值上限,结果判定为阳性;标本 OD值
7.1.2.2 A.2.2 ELISA法检测麻疹IgG抗体
7.1.2.2.1 A.2.2.1 用途
主要用于定性和/或定量检测人血清或血浆中抗麻疹病毒的IgG抗体,用于麻疹诊断或人群抗体水平调查。
7.1.2.2.2 A.2.2.2 操作步骤(或按照试剂使用说明书进行)
A.2.2.2.1 定量ELISA法检测麻疹病毒IgG抗体的标本稀释法
应使用1000μL稀释缓冲液对10μL患者待测样品进行稀释,制成患者标本稀释液,最终标本稀释比例为1:100。
A.2.2.2.2 检测过程
A.2.2.2.2.1 将检测所需数目的微孔条放到微孔板框上并准备好一张标签。
A.2.2.2.2.2 在微量孔内分别加入100μL的已稀释样本或立即可用的对照血清。留一个孔作为底物空白,例如:
A.2.2.2.2.3 将样品于湿盒内(37±1) ℃孵育(60±5)min。
A.2.2.2.2.4 孵育后以洗液缓冲液洗涤板孔(使用自动洗板机或手工洗板)。先吸去或甩去洗液;然后每孔内加入300μL洗液,再吸去或甩去洗液,重复洗涤过程共4次;最后将微孔板翻转过来在纸巾上拍干,使微孔中不再含有液体。
A.2.2.2.2.5 加入酶标记抗体:于相应孔内(底物空白孔除外)加入100μL IgG酶标记抗体,湿盒内(37±1)℃孵育(30±1)min。
A.2.2.2.2.6 以洗液缓冲液洗涤板孔(见A.2.2.2.2.5)。
A.2.2.2.2.7 加入底物:于每孔内加入100μL底物溶液(包括底物空白孔),湿盒内(37±1)℃孵育(30±1)min。
A.2.2.2.2.8 终止反应:每孔内加入100μL终止液,轻微振荡微孔板以混合溶液。
A.2.2.2.2.9 读取OD值:以底物空白孔为空白对照,60 min内读取OD值。
7.1.2.2.3 A.2.2.3 质量控制标准
A.2.2.3.1 底物空白孔的OD值必须<0.25。
A.2.2.3.3 标准血清的平均OD值必须在有效范围内,此范围己在试剂盒专用的质量控制证书中给定(减去底物空白之后)。
A.2.2.3.4 如果未达到以上标准,则试验无效且必须重做。
7.1.2.2.4 A.2.2.4 结果评估
根据标准血清OD值计算CUT-OFF值上限和下限,标本OD值≥CUT-OFF值上限,结果判定为阳性;标本 OD值
7.2 附录B(规范性附录)病原学诊断方法
7.2.1 B.1 病毒分离
7.2.1.1 B.1.1 标本采集与处理
7.2.1.1.1 B.1.1.1 标本采集
用于病毒分离的标本包括咽拭子和尿液。宜在麻疹病例出疹前5d至疹后5d内取上述标本。
7.2.1.1.2 B.1.1.2 标本处理方法
B.1.1.2.1 咽拭子标本
将无菌棉拭子稍蘸生理盐水,反复涂抹患者咽部数次,然后将棉拭子浸于1 mL~2 mL标本维持液(含500~1000单位(Unit,U) /mL青霉素、500μg/mL~1000μg/mL链霉素和2%牛血清DMEM液)或者 VTM中,并反复挤压后,弃棉拭子。标本维持液中最好加无细胞毒性的制霉菌素50μg/mL或二性霉素5μ g/mL,接种细胞前置于4℃过夜,用于灭活真菌。
无菌收集30 mL~50 mL中段尿液于50 mL带螺旋盖的无菌塑料离心管中,当日尽快冷藏送至实验室,2000 Rpm,离心5 min,弃上清,沉淀用2 mL标本维持液或VTM重悬,重悬后的标本液于-70℃冻存;未经离心的尿液不得冷冻。
7.2.1.2 B.1.2 标本接种
上述处理后的标本,接种细胞前需要至少-70℃冻融一次,以利于病毒从上皮细胞释放。取0.3 mL~0.5 mL标本液接种于生长良好的单层传代细胞系如非洲绿猴肾细胞/淋巴细胞信号激活因子转染的非洲绿猴肾细胞(Vero cell transfected to express the human signaling lymphocyte activation molecule, Vero/SLAM)上,置37℃吸附1 h~2 h后弃液,再加入维持液,置37℃培养,次日观察有无细胞毒性,必要时换液。
7.2.1.3 B.1.3 观察CPE
接种后每天观察CPE的进展情况,连续观察7d,如果有特征性的麻疹病毒CPE出现,观察直到75%以上的细胞发生病变(CPE+++),-70℃冻存。若无CPE,即置-70℃冻化3次,再盲传1代~2代。
7.2.1.4 B.1.4 毒株鉴定
可以采用荧光定量RT-PCR、RT-PCR和序列测定等方法进行麻疹病毒株的鉴定(见附录B.2)。
7.2.2 B.2 病毒核酸检测
7.2.2.1 B.2.1 标本收集与处理
参考B.1.1,进行标本的收集与处理。在标本的运送过程中,注意低温条件运输,在标本送至实验室后,不要反复冻融标本,以免核酸发生降解。
7.2.2.2 B.2.2 病毒核酸提取
使用商品化的试剂盒或自动核酸提取仪,操作方法参照试剂盒介绍和/或自动核酸提取仪仪器使用说明。也可以采用TRIZOL法提取,具体步骤如下:
a) 取250μL病毒悬液加到1.5 mL离心管中,然后加入750μL TRIZOL溶液,混匀5s后离心;
c) 室温放置10 min,然后在室温,10000 RPM离心20 min;
f) 室温静置至少15 min;
g) 4℃,13000 RPM离心25 min;
i) 4℃,13000 RPM离心20 min;
k) 室温干燥后加入15μL DEPC处理后的H2O,并加入20 U的RNasin(RNA酶蛋白质抑制剂),-20℃保存。
注:整个操作过程要带口罩和一次性手套。
7.2.2.3 B.2.3 荧光定量RT-PCR方法检测麻疹病毒核酸
7.2.2.3.1 B.2.3.1 反应体系
7.2.2.3.2 B.2.3.2 引物和探针序列
B.2.3.2.1 上游引物序列:5'-TGG CAT CTG AAC TCG GTA TCA C-3' B.2.3.2.2 下游引物序列:5'-TGT CCT CAG TAG TAT GCA TTG CAA-3' B.2.3.2.3 探针序列:5'(FAM)-CCG AGG ATG CAA GGC TTG TTT CAG A-3'(BHQ)
7.2.2.3.3 B.2.3.3 反应条件
42℃……………………5 min
55 ℃……………………10s
95℃……………………5s
55℃……………………30s
注:荧光标记和采集时间参照试剂盒介绍。
7.2.2.3.4 B.2.3.4 结果分析和判断
7.2.2.4 B.2.4 麻疹病毒鉴定和基因定型靶基因的扩增及序列测定
7.2.2.4.1 B.2.4.1 N基因羧基末端634个核苷酸序列的扩增
B.2.4.1.1 反应体系
B.2.4.1.2 引物序列
B.2.4.1.2.1 上游引物序列:5'-TGG AGC TAT GCC ATG GGA GT-3' B.2.4.1.2.2 下游引物序列:5'-TAA CAA TGA TGG AGG GTA GG-3'
B.2.4.1.3 在PCR仪中按如下过程进行反应
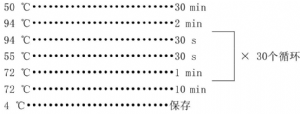
取100 mL电泳缓冲液(1×TAE)加入到干净的三角瓶中,加入1 g~2 g琼脂糖粉末,轻轻摇动三角瓶,使琼脂糖微粒呈均匀混浊状态;微波炉加热使琼脂糖熔化;熔化的琼脂糖自然冷却到70℃左右,倒入己准备好的胶床中,凝胶厚度约为0.3 cm~0.5 cm;室温下静置,凝胶固化。
取己制备好的琼脂糖凝胶,置于电泳槽中;向电泳糟中加入电泳缓冲液(1×TAE),缓冲液的量以超过凝胶表面1 mm~2 mm为宜;用加样器吸取样品5μL,与上样缓冲液混匀后,轻轻加入到凝胶的样品孔中;电压选择100 V,开始电泳。当指示剂迁移到合适位置时,则切断电源取出凝胶;将凝胶放入含溴化乙锭(EB)的溶液中,染色约10 min;凝胶成像仪观察电泳条带,保存记录。也可使用其他商品化的染料代替EB,使用方法参照染料使用说明书。
B.2.4.1.5 PCR产物切胶纯化
使用试剂盒进行PCR产物纯化。具体操作步骤参见试剂盒介绍。
B.2.4.1.6 标记反应
B.2.4.1.6.1 配制标记反应体系
a根据目的条带明亮程度选择用量。
B.2.4.1.6.2 在PCR仪中按如下过程进行标记反应
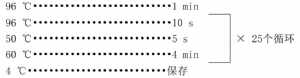
B.2.4.1.6.3 标记反应产物纯化
称量2.7 g G-50粉末放入50 mL离心管中,加入去离子水至50 mL。充分混匀后,室温静置30 min,使之充分水化;向离心柱中加入混匀的G-50混悬液900μL,静置10 min;加压,使多余的水分从离心柱的底部流出;随后将离心柱放在2 mL收集管上,于室温3000 RPM离心2 min;将离心柱转移至1.5 mL离心管中,向凝胶的斜面中央加入标记产物;于室温3000 RPM离心2 min,收集纯化后的标记产物。
B.2.4.1.7 序列测定
将纯化好的标记产物加入到96孔PCR板中,在计算机中输入样品的编号,然后按照序列分析仪的操作介绍进行后续的操作。
B.2.4.1.8 序列整理和分析
从序列测定仪上获得的序列资料,以标准的图形文件(.abl)保存,序列整理使用相关序列分析软件分别对序列进行剪辑,以及基因亲缘性关系、核苷酸和氨基酸同源性分析等。
7.3 附录C(资料性附录)麻疹的病原学、流行病学和临床表现
7.3.1 C.1 麻疹的病原学
麻疹病毒为麻疹的病原体,于20世纪50年代由John Enders和Thomas Peebles首先从麻疹患者的血液中分离得到。麻疹病毒是已知的最具传染性病原体之一,人类是麻疹病毒的唯一自然宿主。
麻疹病毒为有包膜的单链RNA病毒,属于副黏液病毒科的麻疹病毒属。麻疹病毒全基因组中,N(Nucleoprotein,核蛋白)和H(Hemaggglutitin,血凝素)基因变异相对较大,其中N基因羧基末端的450个核苷酸变异最大,该段序列既可鉴定麻疹病毒,又是麻疹病毒基因定型的靶序列。通过对N基因羧基末端的RT-PCR扩增,可达到鉴定麻疹病毒、诊断麻疹的目的;通过对阳性RT-PCR产物进行序列测定和分析,可达到基因定型的目的,同时也能区分疫苗株和野毒株引起的疑似麻疹病例。依据麻疹病毒血凝素和核蛋白基因序列的差异,可以将全球曾经流行的麻疹病毒分为24个基因型,一些国家或地区具有特定的本土基因型,中国近20多年来主要以H1基因型麻疹病毒流行为绝对优势基因型,通过分子流行病学监测可以追踪麻疹病毒的来源和传播途径。
麻疹病毒只有一个血清型,可诱导免疫应答的麻疹病毒膜表面糖蛋白中和抗原血凝素和血融素相对保守,20世纪50至60年代由A基因型麻疹野病毒研制的麻疹减毒活疫苗目前仍在全世界范围广泛应用,对全球消除和强化控制麻疹发挥了关键的作用。很多研究都证实,由于免疫系统尚未发育完全或受母传抗体的干扰,≤6月龄婴儿接种麻疹疫苗往往发生免疫失败比例较高。适龄儿童接种疫苗后,麻疹中和性抗体可以持续很长时间,对麻疹病毒具有长效的免疫力,尽管疫苗诱导产生的抗体随时间的推移而逐渐下降,甚至可能检测不到,但免疫记忆会持续存在。
麻疹病毒侵入人体2 d~3 d后在呼吸道上皮细胞和附近的淋巴结内复制,随着网状内皮组织系统感染出现首次病毒血症,5 d~7 d后,更多的病毒复制发生在局部和末梢网状内皮组织,并发生第二次病毒血症。从前驱症状开始到皮疹出现后3 d~5 d,从鼻咽部标本、血液中的白细胞和尿液标本中均能分离出麻疹病毒。典型麻疹病例出疹后3d内仅约70%左右的患者IgM阳性,4 d~28 d应为100%阳性(轻型麻疹病例IgM的产生会更晚一些)。
7.3.2 C.2 麻疹流行病学
7.3.2.1 C.2.1 流行特征
麻疹病人是唯一的传染源,病毒可经飞沫传播或直接接触感染者的鼻咽分泌物传播,无患病史和麻疹疫苗免疫史的人群普遍易感,其中包括母传抗体己衰减的婴幼儿。所有易感者感染麻疹病毒都是有症状的。易感者感染麻疹病毒,7 d~21 d后出现皮疹。患者在出疹前4d至出疹后4d均具有传染性。对于一个已有免疫力的感染麻疹病毒的人,其IgM抗体水平可能会临时升高且无症状表现,但这些人并无传染性。
麻疹疫苗既有单价疫苗,也有含麻疹成分的联合疫苗,另含风疹、流行性腮腺炎等成分。我国在疫苗应用以前,麻疹呈自然流行状态,发病高峰周期性出现,1951年~1964年,全国报告发病率波动在157.5/10万~1432.4/10万。1965年开始大规模使用麻疹疫苗,随着计划免疫实施和疫苗冷链系统建设以及免疫策略的调整,麻疹发病水平持续下降。1998年我国提出加速麻疹控制规划,2006年开始实施消除麻疹行动计划,2007年实施扩大免疫规划,实施2剂次含麻疹成分疫苗免疫程序,即8月龄接种第1剂(使用麻疹一风疹联合疫苗),18月龄~24月龄接种第2剂(使用麻疹-流行性腮腺炎-风疹联合疫苗)。2004年-2009年先后27个省开展补充免疫,2010年全国统一开展麻疹疫苗补充免疫活动,2009年~2012年全国报告发病率持续下降,2011年和2012年<1/10万。麻疹一年四季均可发生,3月-5月为其发病高峰。发病主要集中在小年龄儿童中,近年来随着发病率的下降,<8月龄麻疹病例所占比例上升明显,部分地区15岁以上麻疹病例占较高比例。
7.3.2.2 C.2.2 麻疹病例感染来源分类
7.3.2.2.1 C.2.2.1 本土病例
实验室或流行病学依据证实病例来源于本土麻疹病毒持续传播,或无证据表明为国(境)外输入病例或国(境)外输入病例的传播所致。
7.3.2.2.2 C.2.2.2 输入病例
有流行病学和/或病毒学依据证实,麻疹病例是在其他国家(地区)感染麻疹病毒。病例须在出疹前7 d~21 d有在其他国家(地区)的暴露史,且在进入境内后21 d内出疹。如果出疹前7 d~21 d期间只有部分时间在其他国家(地区)的,需要对病例接触史进行详尽调查,并对病例感染的病毒做基因定型并与国内外流行株做对比分析,以排除在境内感染的可能性。
7.3.2.2.3 C.2.2.3 输入相关病例
有流行病学和/或病毒学依据证实,在境内感染自国(境)外输入病例或其传播链的病例。如果病毒为非本土基因型但暴露史不详,也视为输入相关病例。
输入病例造成的传播在境内持续超过12个月,此后发生的病例不再属于输入相关病例,应视为输入病毒建立了本土传播。
7.3.2.2.4 C.2.2.4 感染来源不详病例
在已证实消除麻疹的地区,调查无法确认该病例同输入病例或本土病例存在流行病学或病毒学联系的。
7.3.3 C.3 麻疹临床表现
7.3.3.1 C.3.1 类型
7.3.3.1.1 C.3.1.1 典型麻疹
即普通型,临床最为常见。典型麻疹的临床经过可分以下几期:前驱期3 d~4 d,发热,体温达39℃~40℃,流涕、喷嚏、咳嗽、流泪、畏光、结膜炎等,发热2 d~3 d后,口腔颊黏膜粗糙,上有数量不等周围可见红晕的0.5 mm~1 mm灰白色小点,称麻疹黏膜斑(Koplik's spot,柯氏斑),上下唇黏膜也可见到,是早期诊断麻疹的标志;出疹期多在发热2 d~4 d后出现,持续3 d~5 d,自耳后、发际、前额、面、颈部开始自上而下波及躯干和四肢手掌足底,疹间皮肤正常,皮疹初为淡红色斑丘疹,以后部分融合成暗红色,出疹时体温达到高峰,全身症状加重;若无并发症,皮疹出齐后体温开始下降,进入恢复期,皮疹依出疹顺序逐渐隐退,色变暗,有色素沉着及糠皮样脱屑,1周~2周消退,疹退同时体温也下降到正常。
7.3.3.1.2 C.3.1.2 重型麻疹
持续高热在40℃以上,皮疹融合成片,深红色,可见出血性皮疹,病情重且病程长,常伴肺炎、喉炎或有惊厥、昏迷等脑炎表现。
7.3.3.1.3 C.3.1.3 轻型麻疹
临床表现为发热相对轻,多低于39℃,热程短于7d,轻度上呼吸道卡他症状,及少量皮疹,不留色素沉着或脱屑,口腔麻疹黏膜斑仅见1个~2个或无,全身状况良好。无并发症,病程约1周。多见于6个月前婴儿或4周内经过被动免疫的患儿,偶见于接种麻疹疫苗后。机理为机体内的抗体不能完全抵御麻疹病毒的侵袭,但仍有一定的抗病能力,因此病毒在体内只能有限复制。
7.3.3.2 C.3.2 主要并发症
7.3.3.2.1 C.3.2.1 肺炎
是麻疹最常见的并发症,发生率约10%左右,多见于出疹期,也是引起死亡的主要原因。常见于5岁以下、原有佝偻病和营养不良的小儿。由麻疹病毒引起的肺炎多不严重,但有免疫功能缺陷患者(如白血病、先天性无球蛋白血症等)发生严重和致死性的巨细胞性肺炎,其临床特征为缺乏皮疹和血清中不能形成麻疹病毒特异性抗体,其病理变化为间质性肺炎。其他病原所致的继发性肺炎多较为严重,常见的病原为腺病毒、肺炎球菌、葡萄球菌、流行性感冒嗜血杆菌等。
7.3.3.2.2 C.3.2.2 喉炎
发生率为10/~4%,可以是麻疹病毒本身感染所致,多见于2岁~3岁以下婴幼儿,程度轻者预后较好,若继发细菌感染则病情加重,常呈声音嘶哑,犬吠样咳嗽,容易气道梗阻,吸气性呼吸困难,胸部三凹征明显,若不及时处理可窒息。
7.3.3.2.3 C.3.2.3 中耳炎
7.3.3.2.4 C.3.2.4 脑炎
在免疫功能正常的患者,麻疹脑炎的发病率约为麻疹病人的1‰。多见于2岁以上儿童,病死率约为15%,病程1周~2周,脑脊液和血中可查到麻疹IgM抗体。30%的存活者有轻重不等的后遗症。在细胞免疫功能缺陷的患者,可发生麻疹病毒包涵体脑炎,疾病呈急性或亚急性的过程。
7.3.3.3 C.3.3 鉴别诊断
皮疹出现时间 | 多在发热第4d出现 | 多在发热第1d~2d出现 | 多在发热第2d出现 | 多出现发热第3 d~4 d出现 |
皮疹特征 | 暗红色斑丘疹,先于面部,自上而下逐步出现,通常于出疹后第4d开始隐退 | 弥漫性细小密集的猩红色斑点,压之褪色,皮肤皱折处,如肘弯、腋窝、腹股沟等处皮疹密集,形成深红色线条,此外还可见到面部口周苍白区及杨梅样舌 | 皮疹呈淡红色斑疹或斑丘疹,直径约3 mm,周围有浅色红晕,压之褪色,多呈散在性,亦可融合,不痒,皮疹由颈部和躯干开始,1d内迅速散布全身,以躯干及腰臀部较多,面部及四肢远端皮疹较少,肘膝以下及掌跖部多无皮疹 | |
全身浅淋巴结肿胀 | 耳后部、颈部、枕部淋巴结肿胀 | 颈部、枕部淋巴结肿大 | ||
有 | 无 | 无 | 无 | |
脱屑 | 糠屑 | 少数有细糠脱屑或无 | 脱屑较严重,手掌、足跖大片脱皮,有时象手套、袜套样,重者可有脱发 | 无 |
血象 |
8 参考文献
[1] 郭可謇,宋光远,张礼璧.应用抗体捕捉ELISA法测定病毒特异性IgM抗体.病毒学报,1987,3 (1):86-91.
[2] Xu W,Tamin A,Rota JS, et al. New genetic group of measles virus isolated in the People's Republic of China. Virus Res,1998,54: 147-156.
[3] WHO. Measles, mumps and rubella vaccine use and strategies for elimination of measles rubella and Congenital Rubella Syndrome. MMWR,1998,47(RR-8): 1-57.
[4] WHO. Advances in Global Measles Control and Elimination. MMWR,1998,47/No.RR-11 [5] Andrews N, Pebody RG, Berbers G, et al. The European Sero-Epidemiology Network: standardizing the enzyme immunoassay results for measles, mumps and rubella. Epidemiology and infection.2000,125 (1): 127-141.
[6] Edmunds W.J., Gay N.J., Kretzschmar, M., et al. The pre-vaccination epidemiology of measles, mumps and rubella in Europe: implications for modelling studies. Epidemiol. Infect,2000,125: 635-650.
[7] WHO. Global measles and rubella laboratory network-update. Wkly Epidemiol Rec,2005,44: 384-388.
[8] WHO. Press releases WHO Regional EPI targets: eliminate measles and control hepatitis B by 2012. Fifty-sixth session of the WHO Regional Committee for the Western Pacific,2005. [9]余文周,税铁军,李黎,等,全国2004~2006年麻疹流行病学特征和预防控制措施分析,中国计划免疫,2006,12 (5): 337-341.
[10] Wolfson LJ, Strebel PM, Gacic-Dobo M, et al. Has the 2005 measles mortality reduction goal been achieved?A natural history modelling study. Lancet,2007,369: 191-200.
[11] WHO. Manual for the laboratory diagnosis of measles and rubella virus infection.2007, www.who.int/vaccine s-document s/WHO/IVB/07.01
[12] Knipe DM, Howley PM. Fields virology (5th edition). Philadelphia: Lippincott Williams & Wilkins.2007,1551-1585.
[13]马超,罗会明,安志杰,等,全国2006~2007年麻疹流行病学特征及消除麻疹措施分析,中国计划免疫,2008,14 (3): 208-213.
[14] Griffin DE, Oldstone MM. Measles pathogenesis and control introduction. Curr Top Microbiol Immunol,2009,330: 1.
[15] WHO, Measles vaccines WHO position paper. WER,2009,84(35): 349-360. [16] 卫生部.全国麻疹监测方案[S].2009-01.
[17] Zhang Y,Ding Z,Wang H, et al. New measles virus genotype associated with outbreak,China. Emerg Infect Dis,2010,16: 943-947.
[18] 郝利新,马超,马静,等.中国2008~2009年麻疹流行病学特征分析[J].中国疫苗和免疫,2010.16 (4):293-296.
[19]马超,郝利新,安志杰,等.中国麻疹监测系统的建立和运转情况分析[J].中国疫苗和免疫,2010.16 (4):297-303.
[20] Rota PA, Brown K, Mankertz A, et al. Global distribution of measles genotypes and measles molecular epidemiology. J Infect Dis,2011,204(Suppl 1): S514-523.011, 204(Suppl 1): S514-523.