3 基本信息
ICS 11.020
C 50
中华人民共和国卫生行业标准WS/T 639—2018《抗菌药物敏感性试验的技术要求》(Technical specification on antimicrobial susceptibility tests)由中华人民共和国国家卫生健康委员会于2018年12月11日发布,自2019年06月01日起实施。本标准代替 WS/T 125-1999,WS/T 248—2005。
4 前言
本标准按照 GB/T 1.1—2009 给出的规则起草。
本标准代替 WS/T 125-1999《纸片法抗菌药物敏感试验标准》和 WS/T 248-2005《厌氧菌的抗微生物药敏感试验方法》。本标准整合了 WS/T 125-1999 和 WS/T 248-2005 的内容,并做了以下变化:
——增加了常规药敏试验报告原则和报告格式;
——增加了稀释法、梯度扩散法和自动化仪器法等其他药敏试验检测方法;
——增加了少见菌药敏判定标准和商品化药敏试验检测系统的性能验证;
本标准起草单位:北京大学人民医院、安徽省立医院、首都医科大学附属北京友谊医院、北京医院。
本标准主要起草人:王辉、张正、马筱玲、胡云建、苏建荣、王晓娟、陈宏斌、李荷楠。
本标准实施之日起,WS/T 125-1999 和 WS/T 248-2005 废止。
5 标准正文
5.1 1 范围
本标准规定了临床抗菌药物敏感性试验的技术要求,包括常规药敏试验的药物选择和报告、药敏试验方法、各种属细菌药敏试验、常见菌特殊耐药表型检测、药敏试验的质量控制、商品化药敏试验检测系统的性能验证。
5.2 2 术语和定义
下列术语和定义适用于本文件。
2.1
抗微生物药物敏感性试验 Antimicrobial susceptibility testing
检测微生物(本文件特指细菌)对抗微生物药物(本文件特指抗菌药物)的体外敏感性,以指导临床合理选用药物的微生物学试验,简称药敏试验。
2.2
最低抑菌浓度 Minimal inhibitory concentration;MIC
在琼脂或肉汤稀释法药物敏感性检测试验中能抑制肉眼可见的微生物生长的最低抗菌药物浓度。
2.3
折点 Breakpoint
能预测临床治疗效果,用以判断敏感、中介、剂量依赖型敏感、耐药、非敏感的最低抑菌浓度(MIC)或者抑菌圈直径(mm)的数值。
2.3.1
敏感 Susceptible;S
当抗菌药物对分离株的MIC值或抑菌圈直径处于敏感范围时,使用推荐剂量进行治疗,该药在感染部位通常达到的浓度可抑制被测菌的生长,临床治疗可能有效。
2.3.2
中介 Intermediate;I
当菌株的MIC值或抑菌圈直径处于中介时,该数值接近药物在血液和组织中达到的浓度,从而治疗反应率低于敏感菌群。该分类意味着采用高于常规剂量治疗时或在药物生理浓集的部位,临床治疗可能有效。该分类同样可作为“缓冲域”,以防止由微小、不可控的技术因素导致的重大偏差,尤其是毒性范围较窄的药物。
2.3.3
剂量依赖型敏感 Susceptible-dose dependent;SDD
细菌菌株对抗菌药物的敏感性依赖于抗菌药物的剂量。当某种药物对菌株的MIC或抑菌圈直径在SDD范围时,临床可通过提高剂量和(或)增加给药频率等修正给药方案以达到临床疗效。
2.3.4
耐药 Resistant;R
当抗菌药物对分离株的MIC值或抑菌圈直径处于该分类范围时,使用常规治疗方案,该药在感染部位所达到的药物浓度不能抑制细菌的生长,和(或)被测菌株获得特殊耐药机制,且治疗性研究显示该药临床疗效不确切。
2.3.5
对于那些因未现或罕现耐药,而仅具有敏感折点的抗菌药物, 当该药对某分离株的MIC值高于或抑菌圈直径低于敏感折点时,此分类为非敏感。
2.4
流行病学界值 Epidemiological cutoff value;ECV
将微生物群体区分为有或无获得性耐药的MIC值或抑菌圈直径,是群体敏感性的上限。根据ECV,可将菌株分为野生型和非野生型。
2.4.1
野生型 Wild-type;WT
根据ECV值,将抗菌药物(包括抗真菌药物)评估中未获得耐药机制或无敏感性下降的菌株定义为野生型。
2.4.2
非野生型 Non-wild-type;NWT
根据ECV值,将抗菌药物(包括抗真菌药物)评估中获得了耐药机制或存在敏感性下降的菌株,定义为非野生型。
2.5
效价 Potency
抗菌药物中具有抗菌活性的成分,通过同类标准物质测定得出。单位mg/g、IU/g或用百分比表示。
2.6
基本一致性 Essential agreement;EA
待测MIC系统与参考方法MIC值相差不超过1个稀释倍数。当待评估方法为纸片扩散法时,不计算EA。
2.7
分类一致性 Categorical agreement;CA
被评估药敏方法与参考方法判断试验结果为敏感、中介、耐药的一致性。
2.8
极重大误差 Very major error;VME
2.9
重大误差 Major error,ME
2.10
小误差 Minor error
2.11
常规药敏试验 Routine test
2.12
补充(非常规)药敏试验 Supplemental (not routing) test
通过常规纸片扩散法、肉汤或琼脂稀释法以外的方法检测某种或某类药物的敏感性或耐药性,且该方法无需额外试验确证药物的敏感性或耐药性。
2.13
筛选试验 Screening test
提供假定结果的试验。当筛查结果阳性时,需进行附加试验进行确认。
2.14
替代药物试验 Surrogate agent test
当目标抗菌药物的药敏无法检测或替代药物的药敏检测性能优于目标药物时,该药物可替代目标药物进行药敏试验。
2.15
等效药物试验 Equivalent agent test
某药可预测与其密切相关的同类药物的药敏结果,测定该药的药敏试验可减少其他相关药物的检测数量以提高检测效率。
5.3 3 常规药敏试验的药物选择和报告
5.3.1 3.1 药敏试验测试药物的分组
B组:常规测试,但只选择性报告的基本抗菌药物,例如当对A组同类药物耐药时。选择性报告指征还包括:特定部位分离菌(如三代头孢菌素对脑脊液中肠杆菌科菌)、混合感染、多部位感染、患者对A组药物过敏/不耐受/无反应、出于感染控制目的。
C组:包括替代性或补充性的抗菌药物。在某些医疗机构,地方或流行菌株对A组/B组多个药物耐药时,需测试该组药物;当对基本测试药物过敏、或测试少见细菌时、或流行病学和感染控制需要时,需测试的补充药物。
各级实验室结合当地病原谱特征、药物代表性、临床需求和本实验室条件等,确定本室不同菌种/药物测试和报告组合。综合上述原则选择自动化药敏板,当药敏板无法满足需求时,予以补充。
5.3.2 3.2 结果解释分类
实验室测试和报告抗菌药物的MIC值或抑菌圈直径(mm)的结果,按折点分为:敏感(S)、剂量依赖型敏感(SDD)、中介(I)、耐药(R)或非敏感(NS);按ECV分为野生型(WT)或非野生型(NWT)。
5.3.3 3.3 报告原则
5.3.3.1 3.3.1 基本原则
只有当分离株可能有临床意义而非定植或污染时,才可报告药敏试验。药敏试验检测获得性耐药而非天然耐药,实验室应明确各类菌属的天然耐药谱,避免将天然耐药误报为敏感。个别菌属对某些药非常敏感,或该菌引起的感染不需使用抗菌药物时(如大肠埃希菌O157引起的腹泻),常规不需药敏试验。实验室根据药物分组、标本类型等,选择性报告药敏结果。
5.3.3.2 3.3.2 药敏方法和折点的选择
针对不同药物/菌种组合,实验室应选择适当的药敏方法,并制定相应药敏试验的操作程序(包括质控标准、结果解释等)。实验室宜采用国内、外权威机构近两年发布的折点,并每年评审本室药敏检测系统的折点范围;因药敏板条浓度范围受限,无法采用新折点时,需补充相应的耐药表型检测试验,且告知临床。
判定折点的适用性与菌种、药敏方法、检测条件、纸片含量、感染部位、药物(种类、剂量、频次、途径)有关。当上述条件符合相应要求时,折点方适用。对于国际药敏委员会未给出折点的药物,建议采用国内、外专家共识和权威文献等进行操作和判断,并告知临床。
5.3.3.3 3.3.3 药敏报告特殊注意事项
a) 肠道分离的沙门菌属和志贺菌属仅需报告氨苄西林、一种氟喹诺酮类药物和甲氧苄啶/磺胺甲噁唑。肠道外分离的沙门菌属,需增加测试并报告一种三代头孢菌素,必要时测试并报告氯霉素。伤寒样沙门菌(伤寒沙门菌和甲、乙、丙型副伤寒沙门菌)应进行药敏试验,肠道分离的非伤寒样沙门菌一般不进行药敏试验。沙门菌属和志贺菌属对第一代、第二代头孢菌素、头霉素和氨基糖苷类体外可能敏感,但临床治疗无效,所以不测试和报告这些药物。
b) 苯唑西林耐药葡萄球菌对目前可用的β-内酰胺类(除头孢洛林等外)均耐药。测试青霉素和苯唑西林或头孢西丁可以推测其它β-内酰胺类的敏感性。
c) 肠球菌属对氨基糖苷类(除外高浓度的氨基糖苷类)、头孢菌素类、克林霉素和甲氧苄啶/磺胺甲噁唑体外可能出现敏感,但临床治疗无效,不应报告为敏感。
d) 脑脊液分离菌株,不宜常规测试和报告下列药物:仅有口服剂型的药物、第一代和第二代头孢菌素(除外头孢呋辛注射剂)和头霉菌素类、克林霉素、大环内酯类、四环素类和氟喹诺酮类。
e) 呼吸道分离株不应测试和报告达托霉素,尿液分离株不报告氯霉素、克林霉素和红霉素,非尿液分离株不测试和报告呋喃妥因。
f) 罕见耐药表型、广泛耐药或全耐药菌应复核后方可发出药敏报告。一旦确认应报告医院感染控制办公室。实验室保留这些菌株,以备流行病学调查或临床追加额外的药敏试验之需。
5.3.3.4 3.3.4 报告单内容和形式
5.3.3.4.1 3.3.4.1 一般信息
报告单包括:患者信息(姓名、年龄、性别、病历号等)、临床信息(如科室、临床诊断、抗菌药物使用、标本类型等)、实验室信息(包括标本采集时间、送检时间、接收时间和审核报告时间、操作人和审核人双签名)等。
5.3.3.4.2 3.3.4.2 药敏试验
细菌名称应规范化,参见细菌命名标准。宜标注拉丁文名称。药物名称应使用规范的化学通用名称,不使用商品名。宜同时显示药物的中英文名称,且同一类药物不同品种集中排列。
3.3.4.2.2 结果呈现
a) 报告单应明确列出各类药物对该菌种的折点、本实验室所用标准的版本号或出版时间。
b) 若没有折点而借用其他菌种折点或采用权威文献折点,需备注说明。
c) MIC 法报告 MIC 值(单位为 mg/L 或 μg/mL)和结果解释;纸片扩散法报告抑菌圈直径值(应为整数,单位为 mm)。结果解释根据折点或 ECV 判断为 S、I、R、SDD、NS、WT、NWT 等类型。
d) 不报告替代药物的药敏结果。如用于判断金黄色葡萄球菌对苯唑西林耐药性的头孢西丁不应报告。
3.3.4.2.3 特殊耐药表型
宜在报告中明确标注特殊耐药表型,同时对特殊耐药表型进行专业解释,包括含义、机制、用药限制和建议等。对于罕见耐药现象,进行复核,并标示结果状态,如复核中、已复核等。少见和矛盾耐药表型进行确认。
3.3.4.3 报告单备注或注释
a) 形式性注释:用于符号、缩写等的详细解释。
b) 专业性注释:包括概念解释(如特殊菌天然耐药)、临床意义和治疗建议等,专业性注释宜有科学依据。
c) 重要性提示:如“高致病性/高传播性”。
d) 时效性提示:如“若有疑义,请于 48 h 内与实验室联系”。
f) 免责提示:如“该结果仅对该标本负责”,“该结果解释宜结合患者临床表现与治疗反应,仅供参考”等。
5.3.3.5 3.3.5 报告发放
药敏报告应尽快发放。紧急情况应将部分结果先行发出,如血培养和脑脊液等其他无菌体液培养的初步药敏试验结果。无论提前还是延时,报告上应显示时间,并注明报告级别(初步报告或最终报告)。保存抗菌药物敏感性试验资料,至少每年向临床报告流行病学分析结果。
5.4 4 药敏试验方法
5.4.1 4.1 药敏试验方法的分类
药敏试验方法包括:稀释法(包括琼脂稀释法和肉汤稀释法)、纸片扩散法、梯度扩散法和自动化仪器法。稀释法是检测抗菌药物敏感性的定量试验方法,为药敏试验的参考方法。
5.4.2 4.2 稀释法
5.4.2.1 4.2.1 琼脂稀释法
5.4.2.1.1 4.2.1.1 材料
4.2.1.1.1 Mueller-Hinton 琼脂(Mueller-Hinton Agar,MHA)a) 按产品说明称量 MHA 干粉。
b) 103.4 Kpa、121.3 ℃高压蒸汽灭菌 15 min。
c) 立即放至 40 ℃~50 ℃水浴锅备用。
d) 培养基制备完毕后室温下(25 ℃)校正 pH 值为 7.2~7.4。
e) 某些营养要求高的苛养细菌如流感嗜血杆菌、淋病奈瑟菌和链球菌属等,MHA 培养基须加入相应补充物质或使用特殊培养基,详见附录 A。
4.2.1.1.2 抗菌药物梯度稀释a) 抗菌药物梯度稀释液的整个配制过程严格无菌操作。见光易分解的替加环素避光保存,易降解、不稳定的药物如头孢克洛、氨苄西林、克拉维酸和亚胺培南现用现配。
实际称取抗菌药物粉末重量(mg)=实际配制抗菌药物储液的体积(mL)×储液浓度(mg/L)/抗菌药物的效价(μg/mg)
或
实际配制抗菌药物储液的体积(mL)=实际称取抗菌药物粉末重量(mg)×抗菌药物的效价(μg/mg)/储液浓度(mg/L)
d) 配制药物储液:药物储液的浓度不低于 1000 mg/L 或高于待测抗菌药物最高检测浓度的 10 倍。对大多数稳定、且不易降解的抗菌药物,将未用完的储液分装至无菌小管,置于-70 ℃或更低温度贮存,时限为 6 个月。每次使用取一管,避免反复冻融影响其活性。
e) 抗菌药物储液的稀释:采用倍比稀释法制备一系列所需抗菌药物检测梯度。
4.2.1.1.3 含药的 MHA 平皿a) 将梯度对倍稀释的抗菌药物(生长对照 MHA 平皿加无菌水)按 1:9 比例加入 4.2.1.1.1 制备的已高压灭菌完毕且温度在 40 ℃~50 ℃的 MHA 琼脂中。
c) 倾注平皿, MHA 含药琼脂平皿厚度为 3 mm~4 mm。
d) 室温放置冷却至凝固,当日使用或将平皿装入密闭塑料袋中,置于 2 ℃~8 ℃保存,贮存时限为 5 天。
e) 平皿使用前置室温平衡,可置于孵箱中 30 min 使琼脂表面干燥。
5.4.2.1.2 4.2.1.2 操作步骤
4.2.1.2.1 制备初始接种菌悬液被测菌株和质控菌株配制0.5麦氏浊度单位的菌悬液,约1×108CFU/mL~2×108CFU/mL,作为初始接种物,并按一定顺序放入试管架。
4.2.1.2.2 稀释接种菌悬液用无菌肉汤或生理盐水将初始接种物1:10稀释,混匀后将稀释后的接种物按排列顺序分别吸取0.1mL至96孔微孔板。
4.2.1.2.3 接种菌悬液a) 标记含药 MHA 平皿接种点方向。
b) 采用多点接种仪或标准接种环等将稀释后的接种物按顺序分别接种 1 μL~3 μL 至无抗菌药物的生长对照平皿、含梯度药 MHA 平皿表面(从低浓度到高浓度)和第二块生长对照平皿。最终菌液接种量为 104CFU/点(点直径为 5 mm~8 mm)。
c) 平皿室温放置至菌点干燥,但放置时间不超过 30 min。
4.2.1.2.4 孵育置于35 ℃±2 ℃空气环境中孵育16 h~20 h。苛养菌的药敏试验平皿孵育条件和时间见附录A。
4.2.1.2.5 结果判读将平皿置于黑色、无反光背景上读取结果。以抑制细菌肉眼可见生长的最低浓度为MIC。
5.4.2.2 4.2.2 肉汤稀释法
5.4.2.2.1 4.2.2.1 材料
4.2.2.1.1 阳离子校正的 Mueller-Hinton 肉汤 (Cation-adjusted Mueller-Hinton broth,CAMHB)
a) 按产品说明称量 CAMHB 干粉。
b) 103.4 Kpa、121.3 ℃高压蒸汽灭菌 15 min,冷却至室温备用。
c) 培养基制备完毕后宜在室温环境(25 ℃)校正 pH 值为 7.2~7.4。
4.2.2.1.2 抗菌药物梯度稀释液
b) 将配制好的梯度稀释抗菌药物溶液每个梯度按 0.05 mL/孔分装至 96 孔微孔板(微量肉汤稀释法)或按 1 mL/管分装至 13 mm×100 mm 带螺帽的试管中(宏量肉汤稀释法),当日使用或冻存于≤ -20 ℃备用。
5.4.2.2.2 4.2.2.2 操作步骤
4.2.2.2.1 制备初始接种菌悬液
被测菌株和相应质控菌株如大肠埃希菌ATCC 25922配制0.5麦氏浊度单位的菌悬液,作为初始接种物菌悬液。
4.2.2.2.2 稀释接种菌悬液
用4.2.2.1.1制备的CAMHB肉汤将初始接种物1:100倍稀释(微量肉汤稀释法)或1:150倍(宏量肉汤稀释法)稀释,混匀,菌液浓度约为1×106CFU/mL。
4.2.2.2.3 接种菌悬液
a) 将稀释后的接种物按顺序依次吸取 0.05 mL 至 4.2.2.1.2 步骤制备的含等量药 96 孔微孔板或吸取 1 mL 至 4.2.2.1.2 步骤制备的含等量药试管中(最终接种物浓度为 5×105CFU/mL)。
b) 稀释菌液在 15 min 内接种完毕。
c) 同时将稀释后的接种物接种至不含抗菌药物的非选择性琼脂平皿,以检测接种菌悬液的纯度。
d) 微量肉汤稀释法:将稀释后的菌悬液接种至不含抗菌药物微孔作为生长对照,同时设置不加接种菌悬液的含药孔。
e) 宏量肉汤稀释法:设置每一株菌的初始接种物的不含药的生长对照管。
4.2.2.2.4 孵育
a) 接种好的菌液和抗菌药物混合液置于 35 ℃±2 ℃孵箱中孵育 16 h~20 h。
b) 苛养菌的孵育条件和时间见附录 A。
4.2.2.2.5 接种菌悬液的菌落计数
每一批试验应同时进行接种菌悬液的菌落计数,以保证微量肉汤稀释法和宏量肉汤稀释法的最终接种菌悬液浓度为5×105CFU/mL,具体步骤:
a) 4.2.2.2.3 步骤接种完毕后,立即从质控菌株大肠埃希菌 ATCC 25922 的生长对照孔或生长对照管吸取 0.01 mL。
b) 置于 10 mL 无菌生理盐水中(1:1000 倍稀释)。
c) 混匀后,吸取 0.1 mL 均匀涂布在不含抗菌药物的琼脂平皿上(根据不同细菌生长特性选取非选择性营养琼脂平皿)。
d) 置于 35 ℃±2 ℃孵箱中孵育 16 h~20 h 后观测:若平皿生长菌落数为 50 CFU 左右,即为最终接种细菌量为 5×105CFU/mL。
4.2.2.2.6 结果判读
b) 根据生长对照孔/管菌液生长量判定生长终点。革兰阳性球菌检测氯霉素、克林霉素、红霉素、利奈唑胺和四环素时,易出现拖尾现象,读取拖尾现象开始的第一个孔的 MIC 值,忽略微小菌膜。若存在多孔跳孔现象,需重新检测。
5.4.3 4.3 纸片扩散法
5.4.3.1 4.3.1 材料
5.4.3.1.1 4.3.1.1 MHA 琼脂
a) 按下列步骤制备 MHA 培养基:
1) 按产品介绍称量 MHA 干粉,103.4Kpa、121.3 ℃高压蒸汽灭菌 15 min 后放至 40 ℃~50 ℃水浴。
2) 将无菌空平皿(内径 9 cm 或 14 cm)置于超净台水平台面上,晃动摇匀 MHA 后倾倒平皿,每块平皿琼脂厚度为 3 mm~4 mm。
3) 平皿室温冷却后,2 ℃~8 ℃冰箱保存。
b) pH 值:纸片扩散法使用的培养基 pH 值在室温下为 7.2~7.4。
c) 水分:进行药敏试验时,MHA 琼脂表面应湿润,但不能有水滴,平皿盖上不应有水珠。
5.4.3.1.2 4.3.1.2 抗菌药物纸片
药敏纸片为直径6.35 mm、吸水量为0.02 mL的专用药敏纸片。药敏纸片使用前需室温平衡1 h~2 h。纸片需密封贮存于-20 ℃冰箱内。开封后的纸片可置于含干燥剂的螺口塑料或玻璃管中2 ℃~8 ℃保存,不超过1周。
5.4.3.1.3 4.3.1.3 标准比浊管
a) 用硫酸钡比浊管(0.5 号麦氏单位标准比浊管)标定接种菌液浓度。
b) 比浊管制备方法:取 0.048 mol/L 氯化钡(BaCl2)[1.175%(W/V)BaCl2.2H2O] 0.5 mL,加到99.5 mL 的 0.18 mol/L 硫酸(1%,V/V)溶液中,制成比浊管,用光径为 1 cm 的紫外分光光度计测定吸光度值来标定比浊管。0.5 号比浊管在 625 nm 波长的吸光度为 0.08~0.13。选取管径与制备菌液试管相同的螺口试管,每管分装 4 mL~6 mL,密封,置于室温避光环境。使用前漩涡震荡混匀。
5.4.3.2 4.3.2 操作步骤
5.4.3.2.1 4.3.2.1 制备接种菌悬液
a) 被测菌株和标准菌株接种于非选择性培养基如血平皿,置于 35 ℃空气培养 18 h~24 h(孵育条件参照附录 A 进行)。
1) 直接菌落法:选取孵育 18 h~24 h 后的菌落形态一致的且生长较好的 3~5 个菌落;采用接种环或无菌拭子触碰每个菌落顶部,转移至含有 4 mL~5 mL 的胰大豆肉汤或无菌生理盐水中。
2) 肉汤增菌法: 将单个菌落接种至肉汤培养基,置于 35 ℃±2 ℃孵育,至浊度接近规定的浓度(通常孵育 2 h~6 h)。
c) 采用生理盐水或肉汤校正菌液浓度至 0.5 麦氏比浊管(约 1×108CFU/mL~2×108CFU/mL),也可用电子比浊仪。
5.4.3.2.2 4.3.2.2 接种平皿
a) 用无菌棉拭子蘸取菌液,在管内壁将多余菌液旋转挤去。
b) 在 MHA 平皿表面均匀涂布 3 次,每次旋转平皿 60°,最后沿平皿内琼脂边缘涂抹一周。
c) 校正浓度后的菌液在 15 min 内接种完毕。
5.4.3.2.3 4.3.2.3 贴抗菌药物纸片
a) 接种菌悬液后的 MHA 平皿置室温下干燥 3 min~5 min。
b) 用纸片分配器或无菌镊子将抗菌药物纸片紧密贴于平皿。各纸片中心相距≥24 mm。纸片贴上后不应再移动。
5.4.3.2.4 4.3.2.4 孵育
贴上纸片15 min内,须把平皿倒置放于35 ℃孵箱中孵育16 h~18 h。对于某些特殊抗菌药物如苯唑西林或万古霉素,孵育时间需延长至24 h。苛养菌等孵育环境和时间见附录A。
5.4.3.2.5 4.3.2.5 结果判读
a) 将平皿置于黑色背景下,利用反射光从平皿背面用游标卡尺或直尺测量无明显细菌生长区域的直径(含纸片),即抑菌圈直径,取整数位,单位为 mm。
b) 培养基若加入血液,须打开平皿盖,借助反射光,从正面测量抑菌圈直径。
c) 测量万古霉素、利奈唑胺和苯唑西林等的抑菌圈时,使用透射光。
d) 测量甲氧苄啶和磺胺类药物的抑菌圈时,可忽视轻微生长(20%或较少菌苔生长)而测量较明显抑制的边缘。
5.4.4 4.4 梯度扩散法
梯度扩散法是一种结合稀释法和纸片扩散法原理对抗菌药物敏感性直接定量的药敏试验方法。
5.4.4.1 4.4.1 材料
5.4.4.1.1 4.4.1.1 梯度扩散法条
商品化梯度扩散法条是一条5 mm × 50 mm的无孔试剂载体,一面固定有一系列预先制备的、浓度呈连续指数增长的抗菌药物,另一面有读数和判别刻度。梯度扩散法条抗菌药物浓度梯度可覆盖有20个MIC对倍稀释浓度的宽度范围。
5.4.4.1.2 4.4.1.2 培养基
同纸片扩散法。
5.4.4.2 4.4.2 操作步骤
b) 待平皿干燥后,用镊子将梯度扩散法条有 MIC 刻度面朝上,贴在已接种被测菌株的平皿表面,梯度扩散法条全长与琼脂表面紧密接触,试条贴好后不应移动。
c) 置于 35 ℃±2 ℃孵箱中孵育 16 h~18 h。
5.4.4.3 4.4.3 结果判读
读取椭圆形抑菌圈与梯度扩散法条交界点的读值,即为待测抗菌药物的MIC值。
5.4.5 4.5 自动化仪器法
0.5麦氏浊度单位菌悬液的配制方法同纸片扩散法,按照各仪器介绍对菌悬液进行稀释。不同种属细菌稀释后的菌悬液,加入对应的商品化试验板条,上机进行检测。
5.5 5 各种属细菌药敏试验
5.5.1 5.1 各种属细菌药敏试验方法和试验条件
临床常见快速生长非苛养菌、常见苛养菌、不常见菌、潜在生物恐怖病原菌、诺卡菌属和其他需氧放线菌、厌氧菌的药敏试验方法和试验条件见附录A。常见菌各种属细菌药敏折点参照参考文献[1]。
5.5.2 5.2 常见菌特殊耐药表型检测
5.5.2.1 5.2.1 β-内酰胺酶表型检测
临床报告葡萄球菌属、流感嗜血杆菌、卡他莫拉菌、淋病奈瑟菌和一些厌氧菌对青霉素的敏感性前,应进行β-内酰胺酶的补充药敏试验(方法见表1)。青霉素可用于预测上述种属对青霉素酶不稳定的青霉素类的敏感性,包括青霉素、阿莫西林、氨苄西林、羧苄西林、替卡西林、阿洛西林和哌拉西林等。
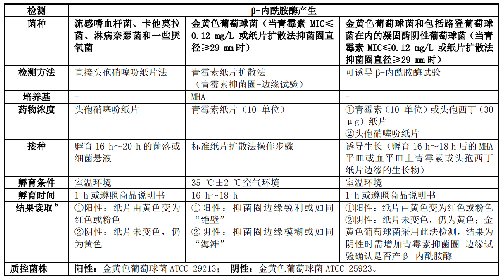
5.5.2.2 5.2.2 葡萄球菌属对苯唑西林耐药性检测
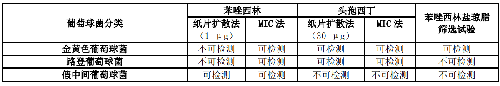
检测葡萄球菌属对苯唑西林敏感性的方法见表 2。苯唑西林或头孢西丁的药敏结果适用于其他对青霉素酶稳定的青霉素类如氯唑西林、双氯西林、氟氯西林、甲氧西林和萘夫西林。苯唑西林或头孢西丁药敏试验结果为敏感,即对 β-内酰胺酶抑制剂复合物、头孢菌素类和碳青霉烯类敏感。一旦检测为苯唑西林耐药,即对所有 β-内酰胺类(头孢洛林除外)药物耐药。
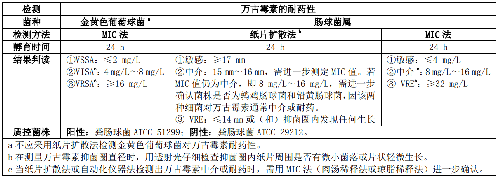
5.5.2.3 5.2.3 万古霉素中介的金黄色葡萄球菌(Vancomycin intermediate S. aureus,VISA)、万古霉素耐药的金黄色葡萄球菌(Vancomycin resistant S. aureus,VRSA)和万古霉素耐药肠球菌(Vancomycin resistant Enterococcus, VRE)表型检测,见表 3。
5.5.2.4 5.2.4 诱导克林霉素耐药性检测
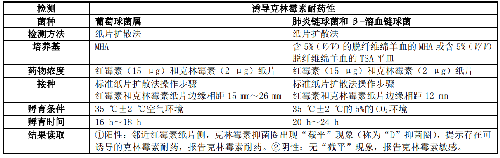
当葡萄球菌属、肺炎链球菌和β-溶血链球菌对大环内酯类如红霉素耐药,而对克林霉素中介或敏感时,宜进行诱导克林霉素耐药性检测,包括纸片扩散法(D试验,表4)、微量肉汤稀释法和自动化仪器法。微量肉汤稀释法是将4 mg/L的红霉素和0.5 mg/L的克林霉素置于同一孔里,35 ℃±2 ℃空气环境孵育18 h~24 h检测后,检测菌株是否生长。生长即为阳性,不生长为阴性。
表4 葡萄球菌属、肺炎链球菌和 β-溶血链球菌的诱导克林霉素耐药性检测方法
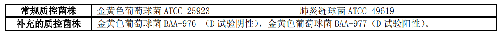
5.5.2.5 5.2.5 肠球菌属氨基糖苷类高水平耐药(High-level aminoglycoside resistance, HLAR)表型检测肠球菌属氨基糖苷类高水平耐药表型检测见表 5。
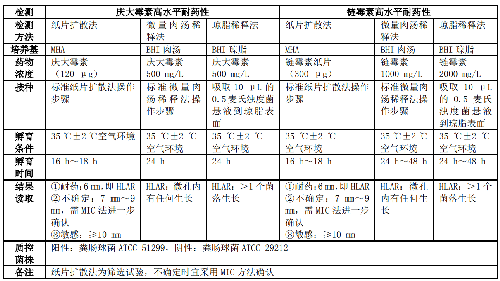
5.5.2.6 5.2.6 产超广谱β-内酰胺酶(Extended-spectrum β-lactamases, ESBLs)表型检测
ESBLs检测适用菌种为大肠埃希菌、肺炎克雷伯菌、产酸克雷伯菌和奇异变形杆菌。ESBLs确证试验包括纸片扩散法、MIC法(稀释法或梯度扩散法)。
纸片扩散法:使用每片含30 μg头孢他啶、头孢噻肟纸片和头孢他啶/克拉维酸(30 μg/10 μg)、头孢噻肟/克拉维酸(30 μg/10 μg)复合物纸片进行检测,当任何一种复合物纸片抑菌圈直径比其单独药敏纸片抑菌圈直径大于或等于5 mm,可确证该菌株产ESBLs。
稀释法:使用头孢他啶(0.25 mg/L~128 mg/L)、头孢他啶/克拉维酸(0.25/4 mg/L~128/4 mg/L)、头孢噻肟(0.25 mg/L~64 mg/L)、头孢噻肟/克拉维酸(0.25/4 mg/L~64/4 mg/L)进行检测,当与克拉维酸联合药物组的MIC小于或等于单独药物组MIC 3个倍比稀释度时(或比值≥8),可确证该菌株产ESBLs。
5.5.2.7 5.2.7 碳青霉烯酶的表型检测
5.5.2.7.1 5.2.7.1 适用条件
当肠杆菌科细菌和铜绿假单胞菌对厄他培南(铜绿假单胞菌不适用)、亚胺培南或美罗培南中任何一种药物中介或耐药时,需进行复核,并检测该菌株是否产碳青霉烯酶,以便采取感染控制措施。碳青霉烯酶表型检测方法为改良碳青霉烯类灭活试验(Modified carbapenem inactivation method,mCIM)等。铜绿假单胞菌碳仅采用 mCIM 试验,肠杆菌科细菌宜同时执行 mCIM 试验和 EDTA-mCIM(eCIM)试验。
5.5.2.7.2 5.2.7.2 具体步骤
a) 血平皿过夜孵育待测菌。
b) 用 1 μL 接种环重悬肠杆菌科细菌(铜绿假单胞菌采用 10 μL 接种环)于 2 mL 胰大豆肉汤(TSB)管中。当检测肠杆菌科细菌产酶株时,再另取一新的接种环重悬待测菌株于另一 2 mL TSB 管中,并吸取 20 μL 0.5 M EDTA(终浓度为 5 mM)置于该管中。
c) 涡旋震荡 10 s~15 s。
d) 分别取 10 μg 美罗培南纸片各一片置于 b)步骤含和不含 EDTA 的 TSB 菌液管中,确保整个纸片浸没在菌悬液中。
e) 35 ℃±2 ℃空气孵育 4 h±15 min。
f) 待孵育时间接近 4 h 时,采用生理盐水制备大肠埃希菌 ATCC 25922 的 0.5 麦氏单位菌悬液,15 min 内按照常规纸片扩散法步骤将其涂布于 MHA 平皿上,干燥 3 min~10 min。
g) 采用 10 μL 接种环从 TSB-美罗培南纸片悬液中取出美罗培南纸片,排出过多液体,将其贴在已接种好大肠埃希菌 ATCC 25922 的 MHA 平皿上,反转平皿,35 ℃±2 ℃空气孵育 18 h~24 h后,测量美罗培南抑菌圈直径。
h) mCIM 结果判读:①阳性:当抑菌圈直径 6 mm~15 mm 或在 16 mm~18 mm 抑菌圈内存在大肠埃希菌 ATCC 25922 菌落时,报告产碳青霉烯酶;②阴性:当抑菌圈边缘清晰可见,且其直径≥19mm 时,报告不产碳青霉烯酶;③不确定:当抑菌圈直径为 16 mm~18 mm 或抑菌圈直径在≥19 mm抑菌圈内存在大肠埃希菌 ATCC 25922 菌落时,不能确定待测菌株是否产碳青霉烯酶,宜用分子方法确认。
i) eCIM 结果判读:仅在 mCIM 阳性才解读 eCIM 结果。若抑菌圈内存在菌落,测量 eCIM 抑菌圈时可忽略不计,直接量取抑菌圈边缘。①阳性:eCIM 抑菌圈直径-mCIM 抑菌圈直径≥5 mm,报告产金属酶;②阴性:eCIM 抑菌圈直径-mCIM 抑菌圈直径≤4 mm,报告不产金属酶,产丝氨酸类碳青霉烯酶。
注:若菌株共产丝氨酸类碳青霉烯酶和金属酶,eCIM 试验为假阴性,此时不能区分二者。
5.5.3 5.3 不常见苛养菌和非苛养菌药敏试验
5.5.3.1 5.3.1 乏养球菌属和颗粒链球菌属
乏养球菌属和颗粒链球菌属属于苛养菌,是感染性心内膜炎的重要致病菌。检测药物为青霉素、头孢噻肟或头孢曲松和万古霉素。来自呼吸道或伤口的分离株不必进行药敏试验,来自无菌部位如血液、深部组织或植入的假体装置,特别是免疫缺陷患者,宜进行药敏试验。药敏试验折点见附录B表B.1。
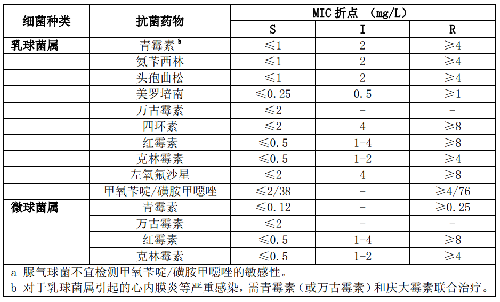
5.5.3.2 5.3.2 气球菌属、孪生球菌属、乳球菌属和微球菌属
气球菌属常规检测药物为青霉素、头孢曲松和万古霉素。孪生球菌属检测药物为青霉素、头孢噻肟或头孢曲松和万古霉素。乳球菌属的检测药物则为青霉素或氨苄西林、头孢曲松、万古霉素、克林霉素和红霉素。格氏乳球菌对克林霉素天然耐药。
微球菌属常为污染菌,多次血培养阳性或植入假体装置分离的菌株可进行药敏试验。其检测药物为青霉素和万古霉素。这些菌属药敏试验折点见附录B表B.2。
5.5.3.3 5.3.3 对糖肽类药物天然耐药的革兰阳性菌
5.5.3.3.1 5.3.3.1 明串珠菌属和片球菌属
明串珠菌属和片球菌属为苛养菌,对万古霉素天然耐药。分离自无菌部位如血培养或深部组织的菌株,尤其是免疫缺陷患者无菌部位分离的菌株可进行药敏试验。检测药物为青霉素或氨苄西林。
5.5.3.3.2 5.3.3.2 猪红斑丹毒丝菌
猪红斑丹毒丝菌为苛养菌,对万古霉素和氨基糖苷类天然耐药。猪红斑丹毒丝菌常规不必进行药敏试验;但因其引起心内膜炎时,宜立即进行药敏试验。检测药物为青霉素或氨苄西林。对青霉素过敏患者,需检测红霉素和克林霉素的敏感性。
5.5.3.3.3 5.3.3.3 乳杆菌属
乳杆菌属通常属于苛养菌。分离自无菌部位如血培养或深部组织等的菌株,尤其是免疫缺陷患者无菌部位分离的菌株需进行药敏试验。检测抗菌药物为青霉素或氨苄西林。干酪乳杆菌、发酵乳杆菌、植物乳杆菌、罗伊氏乳杆菌、鼠李糖乳杆菌、唾液乳杆菌、阴道乳杆菌和玉米乳杆菌对万古霉素天然耐药;而嗜酸乳杆菌、卷曲乳杆菌、加氏乳杆菌、惰性乳杆菌、詹氏乳杆菌、约氏乳杆菌和乳酸乳杆菌对万古霉素敏感。
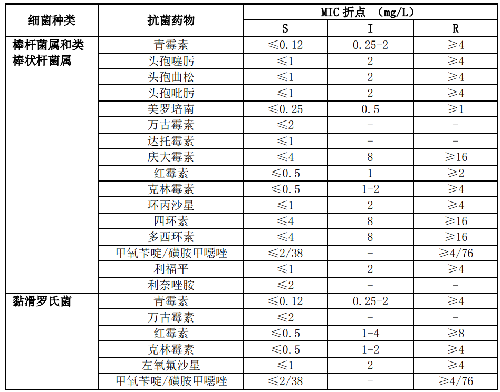
5.5.3.4 5.3.4 棒杆菌属、类棒状杆菌属和黏滑罗氏菌
棒杆菌属、类棒状杆菌属(包括隐秘杆菌属、节杆菌属、短杆菌属、纤维单胞菌属、纤维微菌属、皮杆菌属、利夫森菌属、微杆菌属和厄氏菌属等)和黏滑罗氏菌通常为污染菌或定植菌。分离自无菌部位如深部组织、脑脊液或血培养(多瓶培养阳性)的菌株,尤其是有植入假体装置或免疫缺陷患者无菌部位分离的菌株需进行药敏试验。其检测药物和药敏试验折点详见附录B表B.3。
5.5.3.5 5.3.5 需氧芽胞杆菌属
需氧芽胞杆菌属通常为污染菌,明确为污染菌时,不应进行药敏试验。分离自无菌部位如深部组织、脑脊液或血培养(多瓶培养阳性)的菌株,尤其是有植入假体装置、免疫缺陷或静脉吸毒史患者无菌部位分离的菌株可进行药敏试验。需氧芽胞杆菌属(不包括炭疽芽胞杆菌)检测药物为万古霉素、氟喹诺酮类和克林霉素。该菌属通常对万古霉素、大环内酯类、氨基糖苷类和喹诺酮类药物敏感。蜡样芽胞杆菌和苏云金芽胞杆菌产广谱β-内酰胺酶,通常对青霉素类和头孢菌素类耐药。
5.5.3.6 5.3.6 产单核细胞李斯特菌
产单核细胞李斯特菌对头孢菌素类天然耐药。因该菌通常对氨苄西林或青霉素敏感,因此常规不必药敏试验。其药敏试验仅限于治疗失败或者对青霉素过敏的患者。检测药物为青霉素或氨苄西林、甲氧苄啶/磺胺甲噁唑和美罗培南。这四个药物的敏感性折点分别为≤2 mg/L, ≤2 mg/L, ≤0.5/9.5 mg/L、≤0.25 mg/L,目前尚无中介和耐药的折点。
5.5.3.7 5.3.7 卡他莫拉菌
大部分卡他莫拉菌菌株因产β-内酰胺酶对不耐酶的青霉素(如青霉素、氨苄西林和阿莫西林)类耐药。检测药物包括阿莫西林/克拉维酸、头孢呋辛和甲氧苄啶/磺胺甲噁唑。流行病学调查或重症感染患者分离的菌株宜进行药敏试验,药敏试验折点详见附录B表B.4。
5.5.3.8 5.3.8 HACEK 细菌群和巴斯德菌属
HACEK细菌群包括凝聚杆菌属、心杆菌属、啮蚀艾肯菌和金杆菌属。HACEK群为苛养菌,检测抗菌药物为青霉素、氨苄西林、阿莫西林/克拉维酸、头孢噻肟或头孢曲松、亚胺培南、环丙沙星或左氧氟沙星和甲氧苄啶/磺胺甲噁唑。分离自咬伤部位的艾肯菌属对阿莫西林/克拉维酸高度敏感,不必进行药敏试验。
巴斯德菌属通常对苯唑西林、头孢氨苄和克林霉素耐药,而对氨苄西林、阿莫西林和青霉素的MIC值很少超过0.5 mg/L。检测药物为青霉素类、阿莫西林/克拉维酸、头孢曲松、氟喹诺酮类、大环内酯类、四环素和甲氧苄啶/磺胺甲噁唑。药敏试验折点详见附录B表B.5。
5.5.3.9 5.3.9 气单胞菌属和弧菌属(不包括霍乱弧菌)
气单胞菌属对氨苄西林、阿莫西林/克拉维酸和头孢唑啉均耐药。气单胞菌属检测药物为第三代、四代头孢菌素、氟喹诺酮类和甲氧苄啶/磺胺甲噁唑。采用β-内酰胺类药物治疗气单胞菌属时,该菌可产生诱导性β-内酰胺酶而对超广谱头孢菌素类产生耐药。
弧菌属属于嗜盐菌,嗜盐弧菌属常对磺胺类、青霉素类、头孢噻吩和头孢呋辛耐药。霍乱弧菌检测药物包括氨苄西林、阿奇霉素、氯霉素、磺胺类、四环素或多西环素和甲氧苄啶/磺胺甲噁唑。其他弧菌属检测抗菌药物包括头孢噻肟、头孢他啶、氟喹诺酮类和四环素或多西环素。
气单胞菌属和弧菌属的药敏试验常限于肠道外分离的菌株。药敏试验折点详见附录B表B.6。
5.5.3.10 5.3.10 诺卡菌属和其他需氧放线菌
诺卡菌属和其他需氧放线菌(马红球菌及其他红球菌属细菌、戈登菌属和链霉菌属等)属于专性需氧菌,繁殖速度缓慢。诺卡菌属检测的药物及其折点见附录B表B.7。万古霉素和利福平是治疗马红球菌引起临床感染的重要药物,因此马红球菌药敏需包括这两个药物。其他需氧放线菌如马红球菌、马杜拉放线菌属和戈登菌属仅报告MIC值,尚无药敏折点。
5.6 6 质量控制(Quality control, QC)
实验室宜遵照行业标准建立本实验室药敏试验的质量管理体系,包括质控菌株、质控频率和质控范围等,同时定期参加实验室室间比对项目。
5.6.1 6.1 质控菌株
质控菌株可从ATCC或参考实验室以及商业机构获得。保存其来源和传代等记录,并有证据表明质控菌株性能满足要求。
5.6.2 6.2 质控频率
5.6.2.1 6.2.1 日质控
可按 20 天或 30 天重复方案和 15-重复方案中任意一种执行日质控。
5.6.2.1.1 6.2.1.1 20 天或 30 天重复方案(见表 6)
表6 20 天或 30 天重复方案中可接受标准和推荐措施
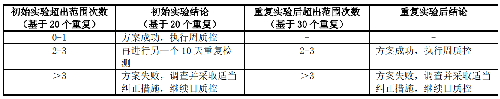
a) 连续检测 20 天或 30 天,记录药物的 MIC 值或抑菌圈直径。
b) 根据检测结果是否在控,决定是否转周质控;若实验室常规每天检测质控菌株,期望将日质控转为周质控,可回顾性分析过去两年连续检测的质控结果,前提是检测系统一致。
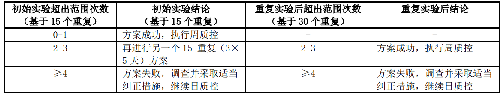
5.6.2.1.2 6.2.1.2 15-重复方案(见表 7)
a) 每天重复测定 3 次,每次单独制备接种物,连续测定 5 天,记录药物的 MIC 值或抑菌圈直径。
b) 根据检测结果是否在控,决定是否转周质控。
表7 15-重复方案中可接受标准和推荐措施
5.6.2.2 6.2.2 周质控:即每周检测 1 次。
当使用同一厂商新批号的培养基时,应执行周质控。若周质控失控,应采取适当纠正措施。对于某些不稳定易降解的抗菌药物,质控频率可增加,不局限于一周一次。
5.6.3 6.3 质控结果失控原因分析和纠正措施
失控原因可分为随机误差、可确认的误差和系统误差。随机误差和可确认的误差可通过简单重复进行质控予以纠正;而系统误差不可通过简单重复进行质控予以纠正。
5.6.3.1 6.3.1 失控原因是可确认的误差(即误差原因易发现和误差易于纠正)
若在失控当天通过重复检测相同质控菌株/抗菌药物组合,其结果在控,可不必进一步纠错。可确认的误差产生的失控原因包括但不局限于以下几方面:
a) 质控菌株:①使用误差的质控菌株;②不当的储存方式;③维护不足(如相同的传代产物超过1 个月);④污染,菌株失活;⑤菌株性能改变(如突变或质粒丢失等)。
b) 检测试剂:①不当的储存和运输环境;②污染;③试管或微孔内肉汤量不足;④板条、琼脂平皿或药敏卡等损坏(如破裂或泄露等);⑤试剂失效。
c) 检测过程:①接种物菌悬液配制方法不当或浊度调节方法不当;②配制接种物使用的细菌孵育时长不当;③配制接种物使用的细菌来源于选择性培养基、含抗菌药物或细菌生长抑制复合物的平皿;④孵育温度或孵育条件不当;⑤使用误差的试剂及配套设备;⑥药敏结果读取方法或结果解释不当;⑦书写误差。
d) 仪器:仪器故障或定标不通过(如微量分液器)。
5.6.3.2 6.3.2 日质控检测,失控为不可确认的误差
执行纠正措施:失控当天采用相同的质控菌株/抗菌药物组合重复进行检测,若在控,继续执行日
质控;若不在控,执行纠正措施,见6.3.4所述。
5.6.3.3 6.3.3 周质控检测,失控为不可确认的误差
执行纠正措施:失控当天重复检测相同的质控菌株/抗菌药物组合,若重复检测的结果在控,且已找到失控的原因,连续五天重复使用同一批号的试剂检测所有抗菌药物/质控菌株组合的质控结果,若:
①5次检测结果均可控,可继续执行周质控;②3次检测结果在控,继续执行连续2天重复检测直至5次结果在控。
5.6.3.4 6.3.4 纠正措施,包括:
a) 若重复检测仍不在控,执行纠正措施。
b) 继续执行日质控直至找到失控原因。
c) 选用新的质控菌株或新的试剂批号或新的品牌。
d) 在寻找失控原因过程中,可采用替代性检测试验。
5.7 7 商品化药敏试验检测系统的性能验证
5.7.1 7.1 受试菌株的选择
选择适用于待验证系统中药物检测的临床菌株,且兼顾药敏板的类型(如验证葡萄球菌专用药敏板时选择葡萄球菌)、每种药物的抗菌谱(如验证糖肽类时只选革兰阳性菌)、检测的范围(如尿液分离株)。敏感和耐药菌株的数量宜均衡。如可能,宜使用已知耐药表型的菌株,或所在地区具有特殊临床意义的耐药菌株(如碳青霉烯耐药肠杆菌科)。产品介绍中未列出的菌种不列入验证范围,可不验证罕见耐药菌(如万古霉素耐药的金黄色葡萄球菌),但实验室应审阅制造商的数据或相关文献。
推荐使用非冻存的、新鲜的临床分离株。为增加菌种的多样性和耐药表型的数量,也可使用冻存菌株、室间质评或其他来源的菌株。检测前,冻存菌株传代2次,且传代后 24 h 内使用。
5.7.2 7.2 受试菌株的数量
每种药敏板至少需要测试30株菌,这样每个药会产生30个药敏结果。对于未达到30个结果的药物,需检测其他菌株或使用质控株的结果以保证每种药物至少有30个药敏结果,但质控株的结果不能超过50%。尽可能选择大量的临床菌株,包括特殊或少见耐药表型菌株。
5.7.3 7.3 对照方法的选择
引入新的药敏检测系统时,需与现有的且验证过的药敏系统进行比较。如果实验室目前无药敏系统,可在新的药敏系统上使用已知药敏结果的贮存菌株进行验证;或与通过权威机构认可的实验室联系,将检测结果与该实验室验证过的药敏系统进行比对;实验室也可通过与参考方法(如微量肉汤稀释法)的比较,验证新的药敏系统(表8)。

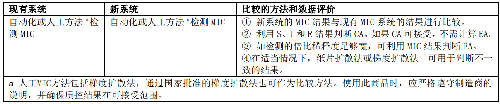
5.7.4 7.4 性能验证期间的质量控制
5.7.4.1 7.4.1 新药敏检测系统
药敏系统验证期间的每一天,应在新系统内进行质量控制。使用合适的针对药敏板的质控菌株。实验室如希望将质控频率从日变到周,需实施质量控制计划,评审质控数据是否支持这种转变。
5.7.4.2 7.4.2 改良的药敏检测系统
当实验室改良已有的药敏检测系统或采用个性化药敏检测系统时,需对变更项目实施个性化质量控制,质量控制方案详见表9。
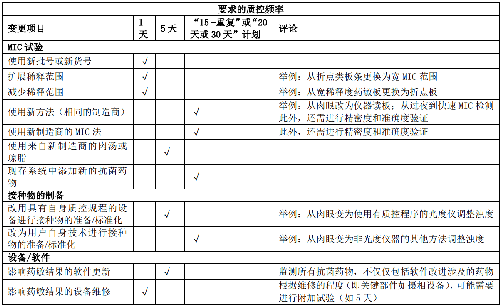
5.7.5 7.5 精密度
指采用相同分析方法对同一菌株连续检测结果的一致性。药敏检测系统精密度评估应考虑正常变异,如抗细菌药物结果差异为±1个倍比稀释度,抗真菌药物结果差异为±2个倍比稀释度时,认为结果相同。
评估时,至少使用5个代表性的质控和临床菌株,每株检测三次。检测可以在一天或多天内进行。
现有系统通常不需进行精密度分析,但是当某一临床菌株在新系统中的结果不可重复时,需在现有检测系统中重新检测。如果现有检测系统的结果仍然不可重复,换一菌株。
评估精密度,至少95%的结果符合EA。此外,至少95%质控菌株的结果在控。
5.7.6 7.6 准确度
指待评估药敏检测系统的结果和对照方法之间结果的一致性。使用相同菌株同时在新系统和对照系统中检测。推荐使用临床菌株。
评估准确度包括在不同检测系统中评估CA和EA,可接受标准为:CA≥90%和EA≥90%。
5.7.7 7.7 药敏试验的数据分析
分析验证数据时,应当只包括抗菌药物适用的临床菌株的结果。如头孢菌素类不用于肠球菌药敏的分析。分析药敏检测系统的结果至少包括CA。如果CA可接受,不需评估EA。如果检测的倍比稀释度有限(如2-3个),不需评估EA;如果倍比稀释度大于4个,且报告的MIC值可用于指导治疗时,评估EA。为及早发现问题,应在评估中而不是评估后分析数据。分类错误或MIC差异超过一个倍比稀释度时,保存菌株并补充可能的附加试验。
5.7.8 7.8 矛盾结果的解决
商品化药敏检测系统之间不一致的结果称为“差异”(discrepancies),而商品化药敏检测系统与参考方法的差异称为“误差”(errors)。实验室应重新检测具有主要分类差异的菌株(如在一个系统中为耐药,但在另一个系统为敏感)。如可能,重复试验最好使用相同的接种物同时在两个系统上检测,并重复三次。如重复试验结果仍不一致,使用第三种方法,优选是参考方法。此参考方法为该产品开发时所用的方法(见产品介绍上)。
实验室记录参考方法检测的结果,比较新系统与参考方法结果间的相关性。如结果一致,不需要附加检测;如不一致,实验室宜向制造商咨询。制造商可能要求提供这些菌株用于附加试验。检测结果不一致的菌株,应在故障排除后和/或完成制造商建议的纠正措施后重新检测。
5.7.9 7.9 可接受标准
虽然商品化检测系统在获批前已建立了严格标准(包括EA和生长不足等),但是实验室仍有必要分析自己的数据以确保检测系统正常运行。“差异”[重大差异(major discrepancy, MD) 和 极重大差异(very major discrepancy,VMD)]指不同药敏试验检测系统之间结果的差别,“误差”(ME和VME)指药敏试验检测系统与参考方法(如微量肉汤稀释法和琼脂稀释法)结果的不同。不是所有的药敏检测系统都使用相同的参考方法。
当符合以下条件时,针对特定药物/临床菌株组合的药敏检测系统,认为通过验证:
a) 与现有系统相比较,CA≥90%和 EA≥90% (如果报告 MIC)。
b) 所有耐药菌株的 VMD 或 VME<3%。
c) 所有敏感菌株的 MD 或 ME<3%。
6 附录A(资料性附录)临床各种属细菌的药敏试验方法和试验条件
临床常见快速生长非苛养菌、常见苛养菌、不常见菌、潜在生物恐怖病原菌、诺卡菌属和其他需氧放线菌、厌氧菌的药敏试验方法和试验条件见表A.1。
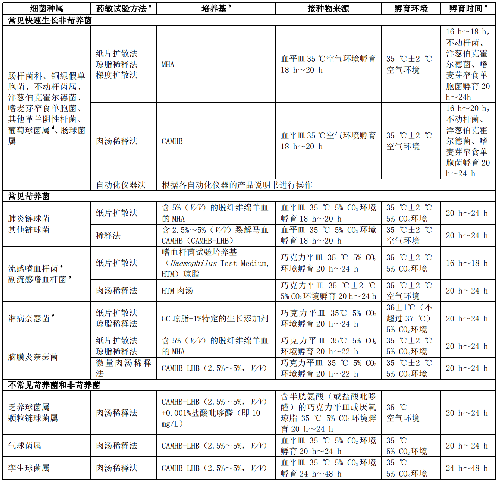
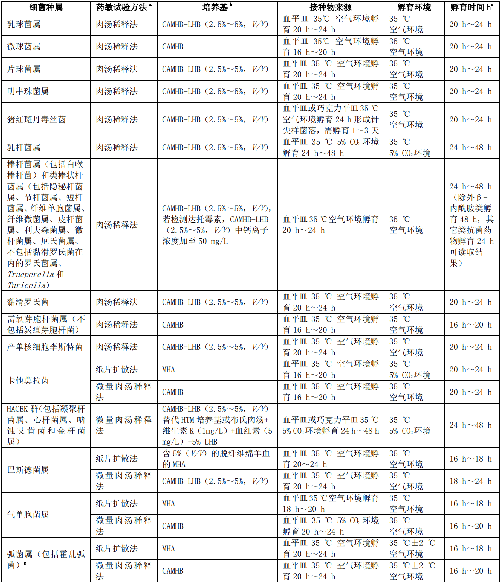
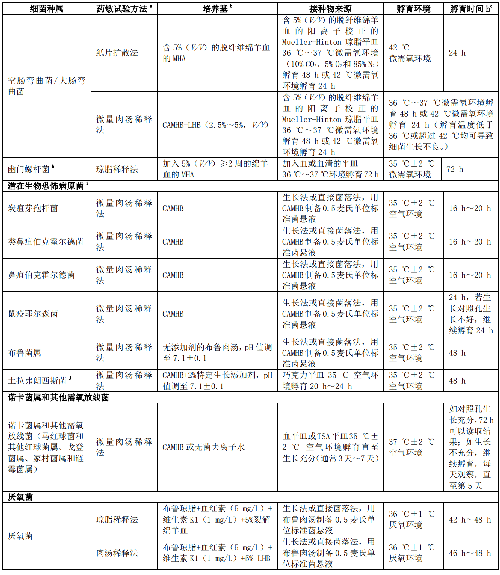

a 采用自动化仪器法和梯度扩散法等进行药敏试验需遵照厂家介绍。自动化仪器法通常只能用于常见细菌,而梯度扩散法可用于苛养菌和少见菌的药敏试验,但需要获得相关管理部门的批件。
b 检测达托霉素时,培养基加入 50 mg/L 的钙离子;检测磷霉素时,加入 25 mg/L 的 6-磷酸葡萄糖;检测达巴万星和奥利万星时,加入 0.002%的聚山梨醇酯-80。
c 纸片扩散法、琼脂稀释法和肉汤稀释法检测苯唑西林和万古霉素的敏感性宜孵育 24 h。纸片扩散法检测头孢西丁的敏感性和凝固酶阴性葡萄球菌对所有抗菌药物的敏感性孵育 24 h。
d 检测葡萄球菌属对苯唑西林的敏感性,须在 CAMHB 加入 2%NaCl。
e 嗜血杆菌属若检测甲氧苄啶或磺胺甲噁唑,培养基中加入 0.2 IU 胸苷磷酸化酶。HTM 肉汤为 CAMHB 中加入 15 mg/L 的β-NAD、15 mg/L 的牛血红素或猪血红素、5 g/L 的酵母提取物。
f 淋病奈瑟菌可采用 CAMHB 或 pH7.0 的 0.9%的磷酸盐缓冲液配制菌悬液。纸片扩散法 1%的特定生长添加剂不宜含半胱氨酸;琼脂稀释法检测碳青霉烯类和克拉维酸时宜含半胱氨酸;检测其他抗菌药物,是否含有半胱氨酸对检测结果影响不大。特定生长添加剂配
制方法如下:将 1.1 g 左旋胱氨酸、0.03 g 盐酸鸟嘌呤、0.003 g 盐酸硫胺素、0.013 g 对氨基苯甲酸、0.01 g 维生素 B12、0.1 g焦磷酸硫胺素、0.25 g NAD、1 g 腺嘌呤、10 g 左旋谷氨酰胺、100 g 葡萄糖、0.02 g 硝酸铁和 25.9 g 左旋半胱氨酸溶于 1L 无菌去离子水中,搅拌混匀。
g 嗜盐弧菌属采用 0.85% NaCl 溶液制备 0.5 麦氏单位标准菌悬液。
h 幽门螺杆菌采用 0.85% NaCl 溶液配制成 2.0 麦氏浊度单位菌悬液。
i 潜在生物恐怖病原菌送至生物安全 II 级 BSL-2 以上的实验室进行操作。对极易产生气溶胶的操作在 BSL-3 实验室进行。
j 土拉弗朗西斯菌:特定生长添加剂配制方法如下,将 25.9 g 左旋盐酸半胱氨酸、1.1 g 左旋半胱氨酸、1 g 腺嘌呤、0.03 g 盐酸鸟嘌呤、0.01 g 维生素 B12、0.1 g 焦磷酸硫胺素、0.25 g 烟酰胺腺嘌呤二核苷酸、10 g 左旋谷氨酰胺、0.02 g 硝酸铁、100 g葡萄糖、3 mg 盐酸硫胺素和 13 mg 对氨基苯甲酸溶于 1L 无菌去离子水中,搅拌混匀。
7 附录B(资料性附录)不常见苛养菌和非苛养菌药敏试验折点
7.1 B.1 乏养球菌属和颗粒链球菌属的药敏试验折点见表B.1。
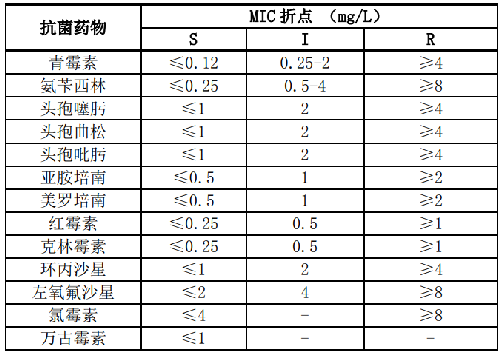
7.2 B.2 气球菌属、孪生球菌属、乳球菌属和微球菌属的药敏试验折点见表B.2。
表B.2 气球菌属、孪生球菌属、乳球菌属和微球菌属的药敏试验折点

7.3 B.3 棒杆菌属和类棒状杆菌属的药敏试验折点见表B.3。
7.4 B.4 卡他莫拉菌的药敏试验折点见表B.4。
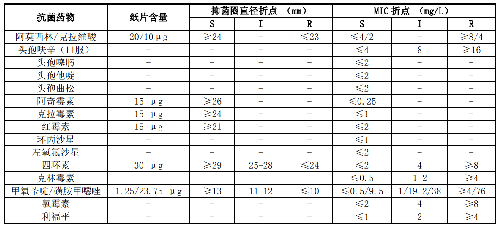
B.5 HACEK群细菌和巴斯德菌属的药敏试验折点见表B.5。
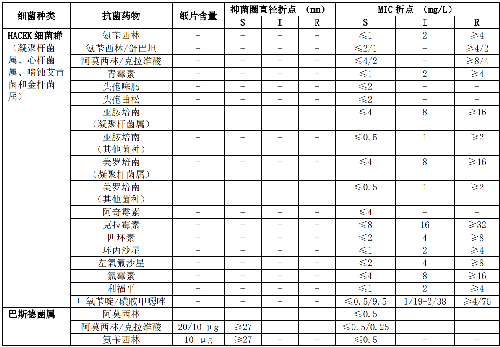
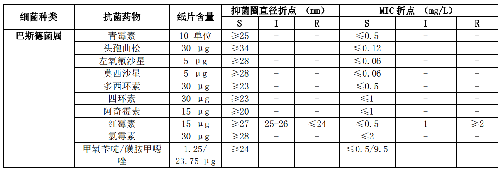
7.5 B.6 气单胞菌属和弧菌属的药敏试验折点见表B.6。
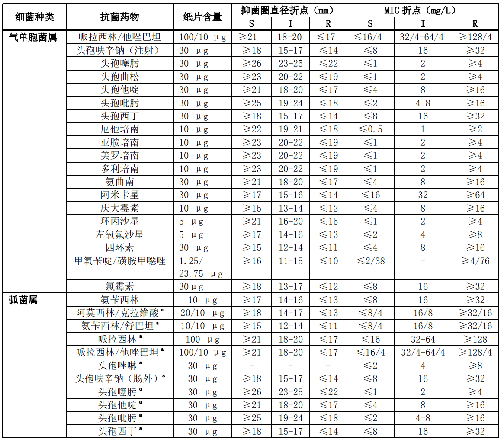
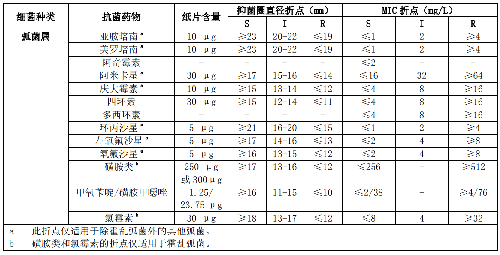
7.6 B.7 诺卡菌属的药敏试验折点见表B.7。
8 参考文献
[1] CLSI M100. Performance standards for antimicrobial susceptibility testing.(http://www.clsi.org).
[2] CLSI M45, 3rd Edition. Methods for antimicrobial dilution and disk susceptibility testing of infrequently isolated or fastidious bacteria, 3rd edition.(2016)
[3] CLSI M02-A12. Performance Standards for Antimicrobial Disk Susceptibility Tests; Approved Standard—Twelfth Edition.(2015)
[4] CLSI M24-A2. Susceptibility Testing of Mycobacteria, Nocardiae, and Other Aerobic Actinomycetes; Approved Standard—2nd Edition.(2011)
[5] CLSI M07-A10. Methods for dilution antimicrobial ausceptibility tests for bacteria that grow aerobically;approved standard-10th edition.(2015)
[6] CLSI M11-A8. Methods for Antimicrobial Susceptibility Testing of Anaerobic Bacteria; approved standard-8th edition.(2012)
[7] CLSI M23, 4th Edition. Development of in vitro susceptibility testing criteria and quality control parameters, 4th edition.(2016)
[8] CLSI M52,1st Edition. Verification of commercial microbial identification and antimicrobial susceptibility testing systems, 1st edition.(2015)
[9] The European Committee on Antimicrobial Susceptibility Testing(EUCAST) Breakpoint tables for interpretation of MICs and Zone Diameters. Version 7.1, http://www.eucast.org/clinical_breakpoints/).(2017)
[10] 中国合格评定国家认可委员会 CNAS-CL42 医学实验室质量和能力认可准则(ISO15189:2012,IDT)
[11] 中国合格评定国家认可委员会 CNAS-GL41 临床微生物检验程序验证指南(2016)
[12] 王辉, 任健康, 王明贵. 临床微生物学检验. 北京:人民卫生出版社, 2015.
[13] 王辉, 宁永忠, 陈宏斌, 等. 常见细菌药物敏感性试验报告规范中国专家共识. 中华检验医学杂志. 2016, 39(1): 18-22.
[14] 王辉, 俞云松, 王明贵, 等. 替加环素体外药敏试验操作规程专家共识. 中华检验医学杂志. 2013, 36(7): 584-587.