1 拼音
W S / T 6 3 0 — 2 0 1 8 rì běn xuè xī chóng kàng tǐ jiǎn cè jiàn jiē hóng xì bāo níng jí shì yàn
3 基本信息
ICS 11.020
C 61
中华人民共和国卫生行业标准WS/T 630—2018《日本血吸虫抗体检测 间接红细胞凝集试验》(Detection of antibody against Schistosoma japonicum—Indirect haemagglutination test)由中华人民共和国国家卫生健康委员会于2018年09月26日《关于发布〈土源性线虫病的传播控制与阻断〉等6项推荐性卫生行业标准的通告》(国卫通〔2018〕21号)发布,自2019年04月01日起实施。
4 发布通知
关于发布《土源性线虫病的传播控制与阻断》等6项推荐性卫生行业标准的通告
国卫通〔2018〕21号
现发布《土源性线虫病的传播控制与阻断》等6项推荐性卫生行业标准,编号和名称如下:
WS/T 630—2018 日本血吸虫抗体检测 间接红细胞凝集试验
WS/T 631—2018 日本血吸虫毛蚴检测 尼龙绢袋集卵孵化法
上述标准自2019年4月1日起施行。
特此通告。
国家卫生健康委员会
2018年9月26日
5 前言
本标准按照GB/T 1.1—2009给出的规则起草。
本标准起草单位:安徽省血吸虫病防治研究所、中国疾病预防控制中心寄生虫病预防控制所、浙江省医学科学院寄生虫病研究所、江苏省血吸虫病防治研究所、江西省寄生虫病防治研究所。
本标准主要起草人:张世清、汪天平、许静、闻礼永、章乐生、郑彬、熊彦红、梁幼生、林丹丹。
6 标准正文
6.1 1 范围
本标准适用于各级疾病预防控制机构和医疗机构对人体血清中日本血吸虫抗体的检测。
6.2 2 术语和定义
下列术语和定义适用于本文件。
2.1
血吸虫病 schistosomiasis
由血吸虫寄生于人和其他哺乳动物所引起的疾病,在我国特指日本血吸虫病(schistosomiasisjaponica)。
注:改写GB 15976—2015,定义3.1
2.2
间接红细胞凝集试验 indirect haemagglutination test
将抗原包被于红细胞表面,成为致敏的载体,然后与相应的抗体结合,通过抗体桥联,出现肉眼可见的凝集现象,以检测样本中的相应抗体。最常用的红细胞为健康人“O”型红细胞。
2.3
可溶性虫卵抗原 soluble egg antigen
血吸虫虫卵经匀浆和超声破碎等处理后离心收集的上清液,含蛋白质、糖蛋白、多糖等多种成分复合物。
6.3 3 仪器设备
3.1 台式低速离心机
最高转速≥2 500 r/min,或最大相对离心力≥800 g。
3.2 平板微量振荡器
3.3 电热恒温水浴箱
控温范围室温+5 ℃~99.9 ℃,温度分辨率/波动度0.1 ℃/±0.5 ℃。
=3.4 微量移液器
量程范围10 μL~100 μL,增量1 μL;量程范围100 μL~1 000 μL,增量5 μL。
6.4 4 试剂材料
4.1 冻干致敏红细胞
主要组成成分为日本血吸虫可溶性虫卵抗原、健康人“O”型红细胞和蔗糖,制备方法参见附录A。
正常兔混合血清,参见附录A。
4.4 稀释液
4.5 血凝反应板
6.5 5 检测步骤
6.5.1 5.1 样本准备
采集末梢血100 μL或静脉血2 mL,室温下放置至血块收缩后,800 g 离心5 min,分离出血清后进行检测,参见附录B。
6.5.2 5.2 样本检测
5.2.1 待测样本编号,从左到右按 1~n 号依次排列。
5.2.2 阴性对照血清、阳性对照血清各加 100 μL 稀释液,使其充分溶解,移液器吹打数次混匀后备用。
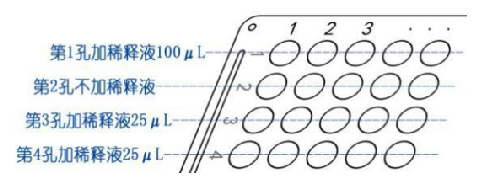
5.2.3 取血凝反应板,横向平放纵向使用。于第 1 列第 1 孔加稀释液 100 μL,第1 列的第3、4孔各加稀释液 25 μL,第 2 孔不加稀释液。
5.2.4 于第 1 列第 1 孔加 1 号待测样本 25 μL,充分混匀后吸出 25 μL 至第2 孔,再从第1 孔吸出25μL至第 3 孔,充分混匀后吸出 25 μL 至第 4 孔,充分混匀后吸出 25 μL 弃去。
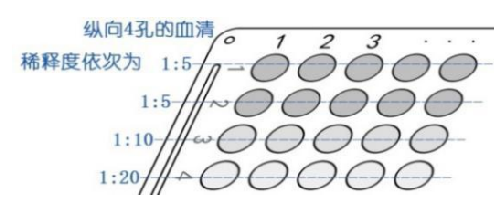
5.2.5 同上操作,依次进行第 2~n 号样本、阴性对照血清、阳性对照血清的倍比稀释,血凝反应板纵向 4 孔的血清稀释度依次为 1:5、1:5、1:10、1:20。
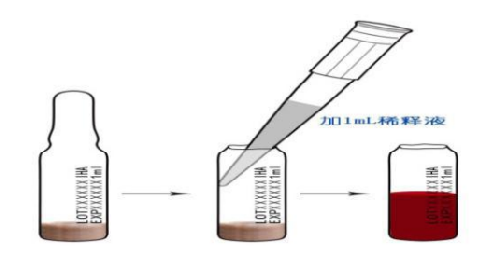
5.2.6 每支冻干致敏红细胞加 1 mL 稀释液,充分混匀后备用。
5.2.7 除每列第 1 孔血清稀释孔外,其余血清稀释孔各加致敏红细胞悬液25 μL,血凝反应板置微量振荡器震摇 1 min~2 min,封板并置 37 ℃电热恒温水浴箱 30 min,在白色背景下观察结果,参见附录B。
6.6 6 结果判定
7 附录A(资料性附录)主要试剂材料制备方法
7.1 A.1 冻干致敏红细胞
7.1.1 A.1.1 可溶性虫卵抗原
取冻干虫卵, 0.01%硫柳汞生理盐水配制悬液,组织匀浆器研磨并置﹣20 ℃反复冻融3次,10000g离心30 min,取上清液。测定蛋白含量后,用硫柳汞生理盐水稀释至0.75 mg/mL,分装到西林瓶,置﹣20 ℃保存备用。
7.1.2 A.1.2 醛化红细胞
A.1.2.1 取健康人“O”型红细胞,用生理盐水洗涤3次,移入刻度离心管,800 g 离心10 min,记录压积红细胞体积。
A.1.2.2 取压积红细胞,每1 mL加 pH 7.2PBS 25 mL混匀,再缓慢滴加2.5%戊二醛2 mL,边滴边摇。室温摇荡1 h,PBS洗涤3次,再用蒸馏水洗涤2次。最后用0.01%硫柳汞生理盐水配成10%醛化红细胞悬液,置2 ℃~8 ℃备用。
7.1.3 A.1.3 鞣化红细胞
A.1.3.1 配制含0.01%鞣酸的生理盐水,与等量的0.1 mol/L pH 7.2PBS混匀。A.1.3.2 取压积醛化红细胞倒入上述溶液中配成1%浓度,置37 ℃恒温水浴振荡器中振摇15min,用 pH 7.2PBS洗涤3次。
A.1.3.3 将洗涤后的红细胞倒入0.1 mol/L pH 6.4PBS溶液中配成1%浓度,充分混匀,即为鞣化红细胞。
7.1.4 A.1.4 致敏红细胞悬液
A.1.4.1 鞣化红细胞悬液中加入终浓度为0.25%的可溶性虫卵抗原,充分混匀,置37 ℃恒温水浴振荡器中振摇45 min致敏。
A.1.4.2 离心沉淀弃去上清液,以含1%正常兔血清(经56 ℃灭活30 min后的血清)的pH7.2PBS洗涤沉淀以去除未结合的可溶性抗原,再以含1%正常兔血清的 pH 7.2PBS配制4%浓度致敏红细胞悬液。
7.1.5 A.1.5 冻干致敏红细胞
在致敏红细胞悬液中加入蔗糖(10%终浓度)和正常兔血清(2%终浓度)。摇匀后分装于2mL的安瓿瓶内,每支0.5 mL。将分装后的致敏红细胞放入冷冻干燥机内进行冻干,并用封口机进行封口。冻干致敏红细胞外观为褐色或淡红色疏松体,间接血凝法测定阳性对照血清效价不低于1:640,测定阴性对照血清效价不高于1:5。
7.2 A.2 阳性对照血清
WS/T 630—20185选择体重2.5 kg~3.0 kg的健康家兔,每只感染800条~1 000条日本血吸虫尾蚴,饲养60 d后,抽取心脏全血,分离血清,混合后按每支0.1 mL分装于微量离心管冻干,作为阳性对照血清。阳性对照血清检测效价不低于1:640。
7.3 A.3 阴性对照血清
选择体重2.5 kg~3.0 kg的健康家兔,抽取心脏全血,分离血清,选出没有溶血的血清灭活补体(56℃灭活30 min),混合后按每支0.1 mL分装微量离心管冻干,作为阴性对照血清。阴性对照血清检测效价不高于1:5。
7.4 A.4 稀释液
称取十二水合磷酸氢二钠35.8 g,氯化钠8.5 g,加去离子水(或蒸馏水)至1 000 mL,称A液;称取磷酸二氢钾6.8 g,氯化钠8.5 g,加去离子水(或蒸馏水)至1 000 mL,称B液。按A液:B液为72:28的比例混合,即为pH 7.2磷酸盐缓冲液。
8 附录B(资料性附录)操作程序
8.1 B.1 操作步骤示意图见图B.1。
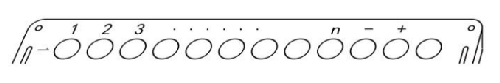
a) 样本编号

c) 血凝板加稀释液

d) 待测样本稀释
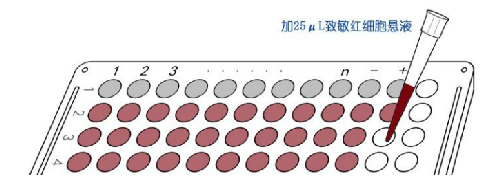
图B.1 操作步骤示意图
8.2 B.2 操作注意事项
B.2.1 样本采集与保存:末梢血一般采用聚乙烯塑料管采集,塑料管孔径2 mm,长度10 cm。静脉血一般采用一次性真空采血管采集。全血采集后应在4 h内进行血清分离。血清样本不能混有红细胞或被细菌污染,血清量应不少于25 μL。血清样本若不能及时检测,可在2 ℃~8 ℃保存3 d~5 d,长时间保存应置于﹣20 ℃以下冷冻保存。
B.2.2 试剂准备:检测试剂如果从冰箱取出,应放在室温条件下平衡30 min以上再行使用。
B.2.3 加样:使用移液器加样,每检测一个样本应更换吸头,在倍比稀释待检血清中,混匀时应避免产生气泡(混匀吸打都在第一档位进行)而影响吸液量的准确性。
B.2.4 致敏红细胞悬液:配置好的红细胞悬液使用前需充分混匀,多样本操作时需在加悬液过程中不时混匀悬液,以免悬液中的红细胞沉底而影响结果的准确性。
B.2.5 加样后的血凝反应板应封板(加盖玻璃板或一次性封口膜,或放置密闭湿盒内)后,方可置37℃电热恒温水浴箱。
B.2.6 结果观察:应在10 min内完成结果观察;观察结果时不宜震摇反应板,以免凝集分散,影响结果判断。
B.2.7 血凝反应板的清洗:血凝反应板应使用96孔“V”型有机玻璃板,使用后应及时清洗。清洗时不可用锐物擦洗或用酸碱溶液浸泡,可使用清洗器或高压自来水冲洗干净,再用蒸馏水清洗1次~2次,甩干后倒置于37 ℃温箱烘干备用。
9 附录C(规范性附录)结果判定标准
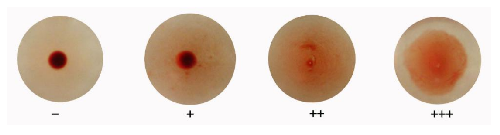
C.1 阴性反应:红细胞全部下沉在孔底,形成紧密、边缘光滑的小圆点。以“-”表示反应强度。
C.2 阳性反应:红细胞出现程度不同的凝集反应。以“+” “++”和“+++”表示反应强度。“+”红细胞大部分沉集于孔底,形成一圆点,周围有少量凝集的红细胞,肉眼见周边模糊(或中间出现较为明显的空白点)。
“++”红细胞多数在孔底周围形成薄层凝集,孔底中心可见少量红细胞下沉的小圆点。“+++”红细胞形成薄层凝集,布满整个孔底,边缘呈现不规则的皱褶。
10 参考文献
[1] Kagan I G. Hemagglutination after Immunization with Schistosome Antigens.[J]. Science,1955,122(122):376-377.
[2] 杨赞元,苏瑞云. 致敏冻干血球微量间接血凝试验诊断血吸虫病的研究[J]. 中国寄生虫学与寄生虫病杂志,1985(1):17-19.
[3] 吴福东,谢治民,袁斯姣,等. 间接血凝试验诊断血吸虫病的研究[J]. 中国血吸虫病防治杂志,1991,(3):138-141.
[4] 卫生部疾控司.血吸虫病防治手册[M]. 上海科学技术出版社,2000.第三版.
[5] 许静,冯婷,郭家钢,等. 我国几种日本血吸虫病免疫诊断试剂的综合测评[J]. 中国血吸虫病防治杂志,2005,17(2):116-119.
[6] WS 261-2006,血吸虫病诊断标准[S]. 北京:人民卫生出版社,2006.
[7] 王恩木,许强,张世清,等. 检测日本血吸虫抗体标准化间接血凝试剂盒的研制[J]. 中国病原生物学杂志,2007, 2(6):421-423.
[8] 姜唯声,陈年高,黄美娇,等. 日本血吸虫抗体检测试剂盒(IHA法)的研制与应用[J]. 中国血吸虫病防治杂志,2013,25(6):594-597.
[9] 章乐生,王恩木,张世清,等. 日本血吸虫间接血凝法抗体检测试剂盒稀释液的改进[J]. 热带病与寄生虫学,2014,12(4):224-226.
[10] 张聪,王晖,李博,等. 湖北省日本血吸虫病抗体检测试剂盒的质量评价[J]. 公共卫生与预防医学,2015, 26(3):53-55.