1 拼音
W S / T 6 1 7 — 2 0 1 8 tiān mén dōng ān suān ān jī zhuǎn yí méi cuī huà huó xìng nóng dù cān kǎo cè liáng chéng xù
2 英文参考
Reference procedure for the measurement of catalytic activity concentration of aspartate aminotransferase
3 基本信息
CS 11.020
C 50
中华人民共和国卫生行业标准WS/T 617—2018《天门冬氨酸氨基转移酶催化活性浓度参考测量程序》(Reference procedure for the measurement of catalytic activity concentration of aspartate aminotransferase)由中华人民共和国国家卫生健康委员会于2018年08月20日《关于发布〈临床实验室定量检验结果的自动审核〉等两项推荐性卫生行业标准的通告》(国卫通〔2018〕16号)发布,自2019年03月01日起实施。
4 发布通知
关于发布《临床实验室定量检验结果的自动审核》等两项推荐性卫生行业标准的通告
国卫通〔2018〕16号
现发布《临床实验室定量检验结果的自动审核》等两项推荐性卫生行业标准,编号和名称如下:
WS/T 616—2018 临床实验室定量检验结果的自动审核
WS/T 617—2018 天门冬氨酸氨基转移酶催化活性浓度参考测量程序
上述标准自2019年3月1日起施行。
特此通告。
国家卫生健康委员会
2018年8月20日
6 标准正文
6.1 1 范围
本标准规定了在临床医学应用中,测量天门冬氨酸氨基转移酶催化活性浓度的参考测量程序。
本标准主要适用于参考实验室,作为天门冬氨酸氨基转移酶催化活性浓度测量的溯源,也可作为与酶催化活性浓度检验有关的仪器和试剂生产企业的溯源,可供有关认可监督管理单位及质量管理部门应用。此参考测量程序可用于我国临床常规方法测量结果的溯源。
6.2 2 规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
ISO 15193 体外诊断器具-生物源样本中量的测量-参考测量程序的表述
6.3 3 术语和定义
下列术语和定义适用于本文件。
3.1
实验室样品 laboratory sample
准备送到实验室或实验室接收的用于测定的原始样品或原始样品的分样品。
3.2
3.3
分析部分 analytical portion
注:如果不需预处理,分析部分直接从原始样品或实验室样品中取出。某些情况下,需将分析部分溶解成分析溶液再上机测定。
3.4
分析溶液 analytical solution
将分析部分溶解在气体、液体或固体中而制备的溶液,溶解过程中可以有反应发生或无反应发生。
3.5
(某一物质系统的)基质 matrix(of a material system)
3.6
参考测量程序 reference measurement procedure
参考程序 reference procedure
在校准或参考物质定值时,为提供测量结果所采用的测量程序,它用于评价由同类量的其他测量程序获得的被测量的量值的测量正确度。
3.7
测量系统的灵敏度 sensitivity of a measuring system
灵敏度 sensitivity
3.8
分析特异性 analytical specificity
3.9
由一个影响量引起的系统测量误差,该影响量自身在测量系统中不产生信号,但它会引起示值的增高或降低。
3.10
影响量 influence quantity
3.11
检出限 detection limit;limit of detection
由给定测量程序获得的测得值,其声称的物质成分不存在的误判概率为β,声称物质成分存在的误判概率为α。
注 1:国际理论和应用化学联合会(IUPAC)推荐α和β的默认值为 0.05。
注 2:有时使用缩写词 LOD。
3.12
校准品 calibrator
6.4 4 缩略语
下列缩略语适用于本文件。
AST:天门冬氨酸氨基转移酶(Aspartate Aminotransferase)
GUM:测量不确定度表达指南(Guide to the expression of Uncertainty in Measurement)
IFCC:国际临床化学与检验医学联合会(International Federation of Clinical Chemistry and Laboratory Medicine)
LD:乳酸脱氢酶(Lactate Dehydrogenase)
MD:苹果酸脱氢酶(Malate Dehydrogenase)
NAD:氧化型β-烟酰胺腺嘌呤二核苷酸(β-Nicotinamide-Adenine-Dinucleotide, oxidized form)
NADH:还原型β-烟酰胺腺嘌呤二核苷酸(β-Nicotinamide-Adenine-Dinucleotide, reduced form)
P-5-P:5′-磷酸吡哆醛(Pyridoxal-5-Phosphoric acid)
QUAM:化学测量中不确定度的评定(Quantifying Uncertainty In Analytical Measurement)
SOP:标准操作程序(Standard Operation Procedure)
6.5 5 测量原理和方法
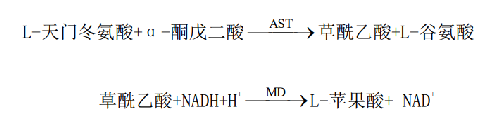
在339 nm下,监测NADH的氧化速率,吸光度的下降速率与AST催化活性浓度呈正比。
6.6 6 测量前试剂准备
6.6.1 6.1 试剂列表
将所用试剂按表1列出。
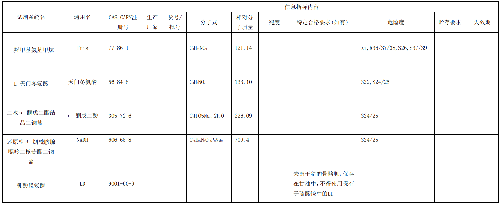
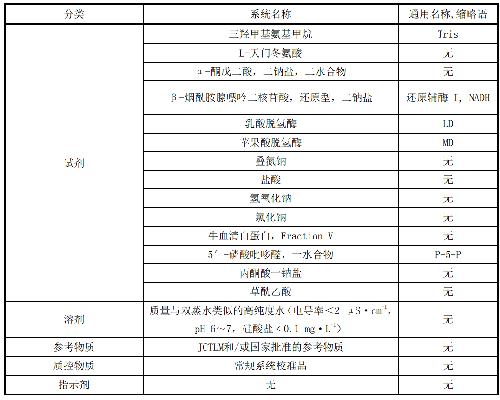
表1 试剂列表
6.6.2 6.2 试剂原料信息
按表2填写试剂原料详细信息。
表 2 试剂原料详细信息

AST测定所用每个试剂原料详细信息见附录A。宜使用最高纯度的试剂。试剂的质量应由供应商提供分析证明。如果怀疑某一种化学物质中含有影响AST催化活性的不纯物,应进行进一步的检测,例如,比较不同厂家和不同批号的产品。建议使用在对比试验中已经鉴定或认可的试剂。以下三种试剂需要注意安全:
盐酸、氢氧化钠和叠氮钠对人体有伤害作用,操作人员应经过专门培训,严格遵守操作规程,根据需要可以佩戴自吸过滤式防毒面具(全面罩)或头罩型电动送风过滤式防尘呼吸器,戴化学安全防护眼镜,穿橡胶耐酸碱材料制成的防护服以及戴橡胶耐酸碱手套等,做好安全防护工作。
6.6.3 6.3 试剂溶液配制
6.6.3.1 6.3.1 一般要求
制备溶液时各成分给出的质量是指100%含量。如果化学物质的含量低于100%[例如y(%)],则应用因子:Fcontent=100/y,计算出与给出质量相当的某化学物质的质量。溶液的制备应使用质量与双蒸水类似的高纯度水(电导率<2 μS·cm-1,pH 6~7,硅酸盐<0.1 mg·L-1)。
每次称重的扩展不确定度(k=2)(包括物质纯度的不确定度)(正态分布),应≤1.5%。
6.6.3.2 6.3.2 溶液 1
称量1.17 g Tris、4.02 g天门冬氨酸(游离酸)、0.052 g叠氮钠,将上述物质按以下步骤处理:
——溶在约 80 mL 水中;
——加 4.2 mL~4.4 mL 5.00 mol·L-1的氢氧化钠溶液;
——搅拌直到试剂完全溶解;
——混合液的pH值应比pH靶值低(约0.3 pH~0.9 pH);
——在 37℃用 2 mol·L-1氢氧化钠溶液调节 pH 到 7.65;
——转移至 100 mL 容量瓶中;
——将容量瓶和水平衡至 20℃;
——加水(20℃)至容量瓶的刻度线。
最终配制的溶液中 Tris 浓度为 96.92 mmol·L-1,天门冬氨酸浓度为 302.4 mmol·L-1,叠氮钠浓度为 8.00 mmol·L-1。该溶液 2℃~8℃稳定性为 3 个月。
注: 加水之后天门冬氨酸不溶解,必须先加氢氧化钠溶液,以5 mol·L-1代替2 mol·L-1氢氧化钠溶液可减少所需用量,精确调整pH值时需用2 mol·L-1氢氧化钠溶液。
6.6.3.3 6.3.3 溶液 2
称量1.17 g Tris、0.052 g叠氮钠,将上述物质按以下步骤处理:
——将上述 2 种试剂溶在约 80 mL 水中;
——在 37℃用 1 mol·L-1盐酸调 pH 值到 7.65;
——转移至 100 mL 容量瓶;
——将容量瓶和水平衡至 20℃;
——加水(20℃)至容量瓶刻度线。
最终配制的溶液中 Tris 浓度为 96.92 mmol·L-1,叠氮钠浓度为 8.00 mmol·L-1。该溶液在 2℃~8℃稳定性为 3 个月。
6.6.3.4 6.3.4 溶液 3
——将 16.7 mg P-5-P 一水化合物用 6mL 溶液 2 溶解;
——转移至 10 mL 容量瓶;
——加溶液 2(20℃)到容量瓶刻度线;
——避光保存(如棕色瓶)。
最终配制的溶液中 P-5-P 浓度为 6.30 mmol·L-1。此溶液在 2℃~8℃稳定性为 1 周。
6.6.3.5 6.3.5 溶液 4
称量16.1 mg NADH二钠盐,按以下步骤处理:
——溶于 2.00 mL 溶液 2 中;
——避光保存(如棕色瓶)。
最终配制的溶液中NADH浓度为11.34 mmol·L-1。此溶液在2℃~8℃稳定性为1周。
6.6.3.6 6.3.6 酶试剂的稀释液
称量1.20 g牛血清白蛋白、0.90 g氯化钠,将上述物质按以下步骤处理:
——将上述 2 种试剂溶于约 80 mL 水中;
——转移至 100 mL 容量瓶;
——将容量瓶和水平衡至 20℃;
——加水(20℃)至容量瓶刻度线。
最终配制的溶液中氯化钠浓度为154 mmol·L-1。此溶液在2℃~8℃稳定性至少1个月。
6.6.3.7 6.3.7 溶液 5
按以下步骤配制:
——用6.3.6中的酶试剂稀释液稀释LD储存液,使LD催化活性浓度在37℃时为3.78 mkat·L-1(226.8kU·L-1)。按式(1)计算稀释LD储存液所需酶试剂稀释液体积。
Vdiluent= VLDSTOCK×(LDSTOCK-226.8)/226.8 ……(1)
式中:
Vdiluent——稀释LD储存液所需酶试剂稀释液体积,单位为毫升(mL);
VLDSTOCK——LD储存液体积,单位为毫升(mL);
LDSTOCK——LD储存液中LD催化活性浓度,单位为毫凯塔尔每升(mkat·L-1)或千单位每升(kU·L-1)。
示例1:见附录B。
——用6.3.6中的酶试剂稀释液稀释MD储存液,使MD催化浓度在37℃时为2.52 mkat·L-1(151.2 kU·L-1)。
按式(2)计算稀释MD储存液所需酶试剂稀释液体积。
Vdiluent= VMDSTOCK×(MDSTOCK-151.2)/151.2 ……(2)
式中:
Vdiluent——稀释MD储存液所需酶试剂稀释液体积,单位为毫升(mL);
VMDSTOCK——MD储存液体积,单位为毫升(mL);
MDSTOCK——MD储存液中MD催化活性浓度,单位为毫凯塔尔每升(mkat·L-1)或千单位每升(kU·L-1)。
示例2:见附录C。
最终配制的溶液中LD催化活性浓度在37℃时为1.89 mkat·L-1(113.4 kU·L-1)、MD催化活性浓度在37℃时为1.26 mkat·L-1(75.6 kU·L-1)。该溶液2℃~8℃稳定性为2 d。
6.6.3.8 6.3.8 反应溶液
分别移取10.000 mL溶液1、0.200 mL溶液3、0.200 mL溶液4、0.100 mL溶液5,将上述溶液充分混匀,避光保存。此溶液在2℃~8℃稳定性为1 d。
6.6.3.9 6.3.9 起始试剂溶液
称量0.326 g α-酮戊二酸二钠二水化合物,按以下步骤处理:
——溶于约 6 mL 水中;
——转移至 10 mL 容量瓶;
——将容量瓶和水平衡至 20℃;
——加水(20℃)至刻度线。
最终配制的溶液中α-酮戊二酸二钠浓度为 144.0 mmol·L-1。此溶液在 2℃~8℃稳定性为 1 周。
6.6.3.10 6.4 温度对缓冲溶液 pH 的影响
当温度偏离 37℃ 时,调节 pH 值的方法:将温度计与 pH 电极同时浸入混合液中。然后将溶液边搅拌边滴定至表中列举在当前测定温度下的 pH 值。在校准、控制和调节 pH 的过程中,搅拌速度要一致。
pH 电极必须位于被搅拌溶液的中心。
配制溶液 1、溶液 2 时,需根据不同温度调整 pH 值,分别按照附录 D 中 D.1 和 D.2 调节溶液 pH 值。
为此,接近靶值时应重新控制温度,同样的方法也适用于 pH 计的温度补偿调节。
6.7 7 测量前仪器准备
6.7.1 7.1 仪器列表
实验室应在表3登记主要测量仪器(分光光度计)和主要辅助仪器(点式温度计、天平、pH计、恒温水浴箱、稀释配液仪、移液器等)。
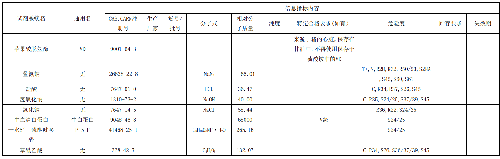
表 3 测量仪器和辅助仪器列表

6.7.2 7.2 仪器性能要求
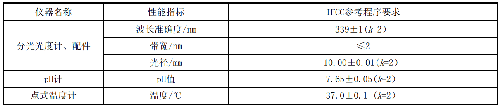
分光光度计及辅助仪器主要性能的要求,见表4。
表 4 分光光度计及辅助仪器主要性能的要求
6.7.3 7.3 分光光度计准备
测量工作前,按已制定的SOP文件对分光光度计进行检查,填入表5。
表 5 分光光度计准备
各实验室可根据具体情况制定本实验室分光光度计准备流程图。
6.7.4 7.4 点式温度计准备
测量工作前,按已制定的SOP文件对点式温度计进行检查,填入表6。
表 6 点式温度计准备
各实验室可根据具体情况制定本实验室点式温度计准备流程图。
6.7.5 7.5 恒温水浴箱准备
测量工作前,按已制定的SOP文件对恒温水浴箱进行检查,填入表7。
表 7 恒温水浴箱的准备
各实验室可根据具体情况制定本实验室恒温水浴箱准备流程图。
6.7.6 7.6 稀释配液仪准备(实验室若有)
测量工作前,按已制定的SOP文件对稀释配液仪进行检查,填入表8。
表 8 稀释配液仪的准备
各实验室可根据具体情况制定本实验室稀释配液仪准备流程图。
6.7.7 7.7 移液器准备
测量工作前,按已制定的SOP文件对移液器进行检查,填入表9。
表 9 移液器的准备

各实验室可根据具体情况制定本实验室移液器准备流程图。
6.7.8 7.8 天平准备
测量工作前,按已制定的SOP文件对天平进行检查,填入表10。
表 10 天平准备


各实验室可根据具体情况制定本实验室天平准备流程图。
6.7.9 7.9 pH 计准备
测量工作前,按已制定的SOP文件对pH计进行检查,填入表11。
表 11 pH 计准备
各实验室可根据具体情况制定本实验室pH计准备流程图。
6.8 8 测量前采样和样品准备
6.8.1 8.1 样品接受信息
宜以表格形式记录样品接收的详细信息,见表12。对不符合样品接收要求的样品应及时与委托方联系。
表 12 AST 样品接收要求
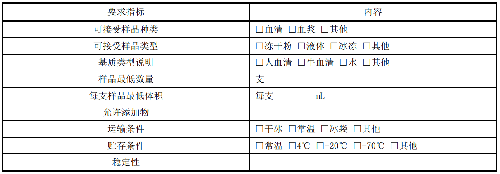

6.8.2 8.2 分析样品的类型
——参考物质(RM);
——质控物质;
——其他标本。
6.8.3 8.3 分析样品的顺序
——参考物质(RM);
——质控物质;
——被分析的“未知”物质。
上述分析样品重复测量可减小测量结果不确定度。从一个分析样品到下一个分析样品的携带污染应小于 0.5%。
6.8.4 8.4 分析样品的处理过程
——AST参考程序测量的分析样品多为冻干粉或深低温的冰冻样品,测量前需处理为均匀的液体状态,分析部分应取自该液体分析样品进行测量。
——对每一类型实验室样品应制定详尽的样品处理SOP文件,并有记录证实操作达到预期要求。实验室样品若为冻干粉或干粉,应使用质量与双蒸水类似的高纯度水(电导率<2 μS·cm-1,pH 6~7,硅酸盐<0.1 mg·L-1)溶解;若为冷冻液体如冰冻血清等,应按SOP文件在严格控制的条件下融解。
——应有处理参考物质的SOP和记录。
6.9 9 测量过程
6.9.1 9.1 测量条件
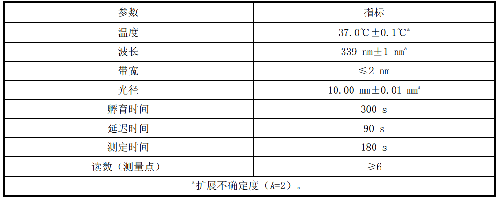
AST 催化活性浓度测量条件见表 13。
表 13 AST 催化活性浓度测量条件
6.9.2 9.2 测量步骤
9.2.1 监测比色杯内温度,达到要求时开始准备试剂和分析溶液。
9.2.2 将实验所需的反应溶液进行脱气处理。可采用的脱气的方法是:采用温度为35℃的真空炉或将溶液加热至35℃,在真空干燥器中储存1h,同时进行磁力搅拌。如果脱气溶液当天不能用完,下次使用前应再次脱气。
9.2.3 将一份适当体积(约 0.400 mL)起始试剂溶液在 37℃下平衡,剩余的起始试剂应保存在 2℃~8℃。
9.2.4 将 6.3 中所列试剂体积按表 14 的顺序加入到反应杯中。
表 14 总体转换率测量的分析系统(AST 催化反应速率和空白率)
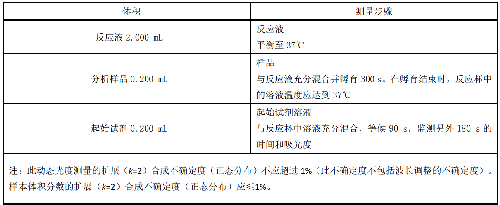
注:此动态光度测量的扩展(k=2)合成不确定度(正态分布)不应超过 1%(此不确定度不包括波长调整的不确定度)。
样本体积分数的扩展(k=2)合成不确定度(正态分布)应≤1%。
9.2.5详细的测量流程见图1

6.9.3 9.3 最终完全反应混和物的浓度
AST 催化活性浓度测定最终完全反应混合物的浓度见表 15。

6.9.4 9.4 试剂空白率测量
为了测量试剂空白率,用9 g·L-1(154 mmol·L-1)NaCl溶液代替分析样品,测量方法同9.2。
注1:试剂空白的反应呈非线性动力学,试剂空白吸光度的绝对变化值如大于0.002 min-1,相关试剂应丢弃。
注2:由于动力学的非线性,试剂空白重复性较差。建议重复测量3次,采用3次测量的平均值参与计算。
6.9.5 9.5 分析样品空白率测量
采用9 g•L-1(154 mmol•L-1)氯化钠溶液代替起始试剂溶液测量分析样品空白率。按上述步骤进行操作。
注:分析样品空白率可被测量和记录,但在计算质控血清和校准品中 AST 催化活性时不考虑。一旦分析样品空白率超过AST 总催化活性的 1%,则警告有关物质不适宜作校准用。
6.10 10 测量结果处理
6.10.1 10.1 测量结果计算
通过回归分析(最小二乘法)计算吸光度随时间改变的变化率。减去试剂空白率后,即校正后的分析样品吸光度变化率。按式(3)计算 AST 催化活性浓度:
式中:
bAST——AST的催化活性浓度,单位为微凯塔尔每升(μkat·L-1)或单位每升(U·L-1);
F ——系数,等于 1905[在 339nm 波长测量时,ε339(NADH)=630 ㎡·mol-1,为 IFCC 与 IRMM 推
荐];
(ΔA/Δt)AST——经过试剂空白率校正后的分析样品吸光度变化率,单位为每秒(s-1)或每分(min-1)。
6.10.2 10.2 数据处理
对于计算的 AST 催化活性浓度,要进行数据处理:
——数据剔除:必要时,每个实验室应建立适当的数据剔除规则;
——计算每批次测量值的均值、标准差,必要时应检查数据分布类型,计算均值的标准差(标准误);
——根据 GUM 和 QUAM 原则计算测量结果的不确定度。
6.10.3 10.3 酶活性单位及换算关系
酶催化活性常用单位为kat·L-1,使用时常出现多位小数,目前常以μkat·L-1或 nkat·L-1表示,但临床医学中仍习惯于使用U·L-1。换算关系如下:
以U·L-1单位表示的催化浓度可通过乘以系数(f=0.01667)转化成μkat·L-1。
6.10.4 10.4 测量不确定度的评定
6.10.4.1 10.4.1 定义被测量
应至少从下面几个方面定义被测量:
——催化活性单位:kat·L-1或U·L-1;
——应考虑到血清中可能存在线粒体型AST(mAST)和细胞浆型AST(sAST);
——溶血时sAST可显著升高;
6.10.4.2 10.4.2 建立数学模型
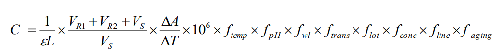
C为输出量,为AST测量的催化活性浓度。影响测量的直接因素有: ⊿A/⊿T为吸光度变化率; 为摩尔吸光系数;L为比色杯光径;VR1为反应液体积;VR2为起始试剂体积;VS为样品体积。影响测量的间接因素有:temp为温度;pH;wl为波长;trans为透光度;lot为试剂厂家与批号;conc为试剂浓度;line为方法线性;aging为试剂老化。
6.10.4.3 10.4.3 不确定度分量的定量
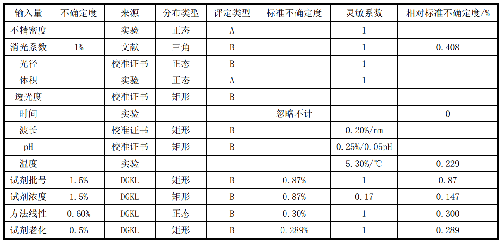
应至少从下面几个方面对不确定度的分量进行定量:
——测量结果的不精密度:一般将同一分析样品分4天测量,每天连续测量3次,计算均值、标准差与变异系数。
——摩尔消光系数的不确定度:根据文献摩尔消光系数的不确定度为1%,可考虑为三角形分布。
——比色杯光径的不确定度:比色杯光径应经有资质的计量院所检定或校准,引用证书上的不确定度,可考虑为正态分布。
——体积的不确定度:在重大测量前应对加反应液(VR1)、起始试剂(VR2)、分析样品(VS)的加样器或相应加样设备进行校准,校准过程中产生的不精密度即为加样的不确定度,分别为uVR1、uVR2、uVS,计算体积项[(VR1+VR2+VS)/ VS]不确定度,先计算分子项不确定度,![]() ,其相对值% u分子=u分子/(VR1+VR2+VS),分母项相对不确定度%u分母= us/Vs,则体积项的相对不确定度
,其相对值% u分子=u分子/(VR1+VR2+VS),分母项相对不确定度%u分母= us/Vs,则体积项的相对不确定度![]() ;应注意计算分母项不确定度时,计算不确定度的绝对值,而不是相对值。
;应注意计算分母项不确定度时,计算不确定度的绝对值,而不是相对值。
——⊿A/⊿t的不确定度:吸光度(A)与透光度和波长的不确定度有关,测量时间(t)的不确定度一般不考虑,因仪器计时器的精度一般都能达到十万分之一,因此可忽略不计。
——透光度的不确定度:根据检定证书上透光度的示值误差计算,一般考虑为矩形分布。
——波长的不确定度:根据检定证书上波长的示值误差和重复性,计算波长的不确定度,一般考虑为矩形分布。
——pH的不确定度:根据pH计检定证书或校准证书上仪器的示值误差和重复性,计算pH计的不确定度,一般考虑为矩形分布。与pH有关的不确定度还应包括pH校准液的不确定度。同时应考虑pH的灵敏系数,可引用德国临床化学学会(DGKL)参考实验室数据(18%)。
——温度的不确定度:根据数字温度计(点温度计)检定证书或校准证书上仪器的示值误差和重复性,计算温度计的不确定度。由于在测量酶催化活性时,对温度的影响不仅来源于温度计,更主要的来源于测量系统的温控,应以实验了解温控系统的变化,计算出温度影响的不确定度。同时应考虑温度影响的灵敏系数,可引用德国临床化学学会(DGKL)参考实验室数据(5.30%/℃)。
——试剂厂家与批号的不确定度:有关不同厂家与不同批号的试剂所引起的不确定度可自行进行实验,也可引用DGKL的数据(1.5%),一般考虑为矩形分布。
——试剂浓度的不确定度:试剂浓度或纯度导致的不确定度,可自行进行实验 ,也可引用DGKL的数据(1.5%),其灵敏系数为17%,一般考虑为矩形分布。
——方法线性的不确定度:方法线性引起的不确定度,可自行进行实验 ,也可引用DGKL的数据(0.6%),一般考虑为矩形分布。
——试剂老化的不确定度:试剂老化所导致的不确定度,可自行进行实验 ,也可引用DGKL的数据(0.5%),一般考虑为矩形分布。
6.10.4.4 10.4.4 建立不确定度预估表
表16 不确定度分量预估表
6.10.4.5 10.4.5 合成标准不确定度
根据不确定度传播律,将上述12个不确定度分量进行合成,即为相对合成标准不确定度uc。
6.10.4.6 10.4.6 扩展不确定度
扩展不确定度相对值:
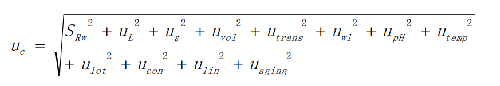
扩展不确定度的相对值乘以测量结果的均值,可得到扩展不确定的绝对值。
6.10.5 10.5 结果确认
6.10.5.1 10.5.1 实验室内结果正确度评估
在进行重要测量前(如给参考物质/校准品赋值、测量室间比对样品等),应先测定JCTLM或国家批准的参考物质,测量结果应在“靶值±不确定度”范围内,否则应确认测量程序的正确度。
6.10.5.2 10.5.2 实验室间比对进行结果确认
AST催化活性浓度参考测量程序由检验医学国际权威学术组织IFCC提出,经多个参考实验室认真评估后经JCTLM批准。30℃参考测量程序和37℃参考测量程序的比较参见附录E。
实验室应有 SOP 文件和记录证实此活动。
6.11 11 结果报告
应设计适宜的测量结果报告格式,包括但不限于以下内容:
——测量所使用的参考程序:IFCC 在 37℃下测量 AST 催化活性浓度的原级参考测量程序;
测量单位:μkat·L-1或U·L-1;
6.12 12 分析可靠性
6.12.1 12.1 概念、价值及其应用
应依据不确定度、精密度、线性范围、检出限等来评估AST参考测量程序的分析可靠性。相关文献及参考测量实验室的有关数据表明本参考测量程序的分析性能优于临床酶活性浓度测量的常规方法,适合于临床常规测量程序的溯源。
6.12.2 12.2 测量不确定度
应根据GUM和QUAM原则计算测量不确定度。按照10.4不确定度计算方法,并结合比对实验室数据,本参考程序的测量结果的相对合成标准不确定度在浓度4.07 μkat·L-1(244 U·L-1)时宜小于2.0%。
6.12.3 12.3 测量精密度
选择2个浓度水平的质控物质,每天测量2次(2次间隔不少于2 h),每次测量均做双份,连续测量20 d,按CLSI EP5-A3文件进行评价。应根据本实验室测量条件评估本参考程序的重复性、期间精密度。
结合比对实验室结果,本参考程序重复性CV宜小于1.5%,期间精密度CV宜小于2.0%。
6.12.4 12.4 检出限
与分光光度计的最小分析信号有关。国际纯粹与应用化学联合会(IUPAC)对检出限的规定,按照AST参考测量程序的操作步骤,测定试剂空白五次,用生理盐水为零值样本,测定20次,计算![]() 与s,以
与s,以![]() +3s为检测限。结合比对实验室数据,本参考程序测量的检出限为0.13 μkat·L-1(7.8 U·L-1)。
+3s为检测限。结合比对实验室数据,本参考程序测量的检出限为0.13 μkat·L-1(7.8 U·L-1)。
6.12.5 12.5 线性范围
参考CLSI EP6-A文件,设定实验室的重复性和线性的允许误差范围分别为1%和5%,选择覆盖IFCC文件提供线性范围20%~30%的高(H)、低(L)浓度水平混合血清,按比例配制成9个系列浓度样本,每个样本重复测量2次,将所得数据进行多项式回归统计,结合比对实验室数据,线性范围检测上限:<4.13μkat·L-1(247.7 U·L-1)。
6.12.6 12.6 误差的来源
误差主要包括以下几个来源:
——AST 测量的线性范围较窄。在孵育过程中,分析样品中高浓度丙酮酸将导致大量消耗 NADH,这样会减少线性范围的上限,并显著降低测量结果。偏离了参考程序中规定的延迟时间和测量时间,导致测量结果与原参考测量程序结果不一致。
——当质控物质和校准品 pH 值与参考程序中描述的 pH 值差别较大时,可导致 AST 测量不确定度增加。
——空气中的 CO2会改变反应液的 pH 值,因此反应液容器应密封。溶液 1 和溶液 2 应至少每周监测一次 pH 值。
6.13 13 质量保证
6.13.1 13.1 实验室环境
结合比对实验室经验,控制室内温度20℃~30℃,湿度30%~70%。
6.13.2 13.2 室内质量控制
每个工作日开始正式测量分析样品前均测量定值的质控物质,质控结果在质控物质靶值±2倍标准差以内,若失控,查找原因直至在可控范围内方可进行实验。应建立包括质控规则、操作步骤的室内质控SOP文件及记录。
6.13.3 13.3 室间质量评价/能力验证
JCTLM在2003年的国际参考实验室能力比对计划(RELA)中将本酶列为比对项目之一。定期参加IFCC和国内权威机构组织的有关参考实验室的室间质量评价计划/能力验证活动,结果应符合要求。当出现不符合情况时,应认真查找原因,建立失控及失控跟踪记录。
6.13.4 13.4 质量日志
每个工作日完成工作日志及环境控制等质量记录。
8 附录B(资料性附录)测定酶储存溶液中 LD 催化活性浓度
8.1 B.1 测量试剂
8.1.1 B.1.1辅助试剂
8.1.2 B.1.2 试剂制备
8.1.2.1 B.1.2.1测定LD催化活性浓度的反应液的组成:
——10.000 mL 溶液 1;
——0.200 mL 溶液 3;
——0.200 mL 溶液 4;
——0.100 mL 水;
——充分混匀,避光保存。
8.1.2.2 B.1.2.2 测量LD催化活性浓度的起始试剂溶液:
——0.0990 g(36.00 mmol·L-1)丙酮酸一钠盐;
——溶于约 6 mL 水中;
——转移至 25 mL 容量瓶中;
——将容量瓶和水平衡至 20℃;
——加水至容量瓶的校准刻度线(20℃)。
最终配制的溶液中丙酮酸浓度为 36.00 mmol·L-1。此溶液置 2℃~8℃稳定性为 1 d。
8.1.2.3 B.1.2.3 LD储存溶液的稀释 (使用前进行):
——在10.000 mL酶试剂稀释液中加入0.050 mL LD原液,充分混匀;第一步的稀释比例是1∶201;
——将经以上稀释的0.050 mL溶液加入到10.000 mL酶试剂稀释液中,充分混匀;第二步的稀释比例是1∶201;第一步和第二步总稀释比例是1∶40401。
注:所用LD酶储存溶液的催化浓度不同于上述步骤时,稀释度不同,需要对稀释因子(F稀释)进行各自调整。
8.2 B.2 测定条件
8.2.1 B.2.1 最终完全反应混合物的浓度,见表B.1。
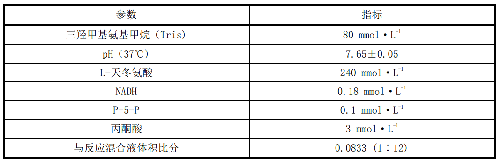
与反应混合液体积比分 0.0833 (1∶12)
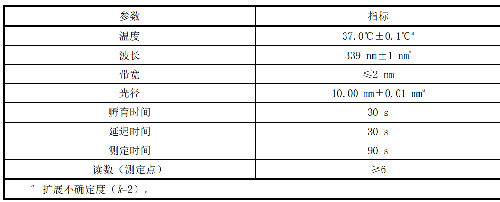
8.2.2 B.2.2 LD催化活性浓度测定条件,见表B.2。
表 B.2 LD 催化活性浓度测量条件
8.3 B.3 测定步骤
8.3.1 B.3.1 试剂准备
将一份适当体积(约0.400 mL)的起始试剂在37℃下平衡,为测量做准备。剩余的起始试剂保存在2℃~8℃。
8.3.2 B.3.2 测量程序
在比色杯中加入2.000 mL反应液,平衡到37℃。加入0.200 mL按照B.1.2.3制备的LD溶液充分混匀,孵育30 s。孵育结束时,比色杯中溶液温度应达到37℃。再加入0.200 mL起始试剂溶液,充分混匀,等待30 s后,再连续监测90 s的吸光度。
8.3.3 B.3.3 试剂空白
用9 g·L-1(154mmol·L-1)NaCl溶液代替LD溶液测定试剂空白,按上述方法进行操作。
8.4 B.4 计算
计算方法与AST催化浓度的计算方法相同,此结果是稀释后的最后溶液中的催化LD浓度。
按式(B.1)计算储存酶溶液中LD催化活性浓度:
LDstock=F×Fdilution×∆A/∆tLD···. ························(B.1)
式中:
LDstock——LD催化活性浓度,单位U·L-1除以1000可得kU·L-1;
F ——系数,等于 1905[在 339 nm 波长测定时,ε339(NADH)=630 ㎡·mol-1];
Fdilution——LD储存液的稀释因子,本例中为40401;
9 附录C(资料性附录)测量酶储存溶液中MD催化活性浓度
9.1 C.1 测量试剂
9.1.1 C.1.1 辅助试剂
9.1.2 C.1.2 试剂制备
9.1.2.1 C.1.2.1 测定MD催化活性浓度的反应溶液:
——10.000 mL 溶液 1;
——0.200 mL 溶液 3;
——0.200 mL 溶液 4;
——0.100 mL 水;
——充分混匀,避光保存。
9.1.2.2 C.1.2.2 测定MD催化活性浓度的起始试剂溶液:
——0.0317 g(4.8 mmol·L-1)草酰乙酸;
——溶于约 40 mL 水中;
——转移至 50 mL 容量瓶中;
——将容量瓶和水平衡至 20℃;
——加水至容量瓶的校准刻度线(20℃);
——将溶液在冰上冷却。
最终配制的溶液中草酰乙酸浓度为 4.8 mmol.L-1。此溶液置 2℃~8℃稳定性为 30 min。
9.1.2.3 C.1.2.3 MD储存溶液的稀释 (用前临时制备):
——取0.050 mL MD贮存溶液至10.000 mL酶试剂稀释液中,并充分混匀;第一步的稀释比例是1∶201;
——取经以上稀释的0.050 mL溶液加至10.000 mL酶试剂稀释液中,并充分混匀;第二步的稀释比例是1∶201;第一步和第二步总稀释比例是1∶40401。
注:所用MD酶储存溶液的催化浓度不同于上述步骤时,稀释度不同,需要对稀释因子(F稀释)进行各自调整。
9.2 C.2 测量条件
9.2.1 C.2.1 最终完全反应混合物的浓度,见表C.1。

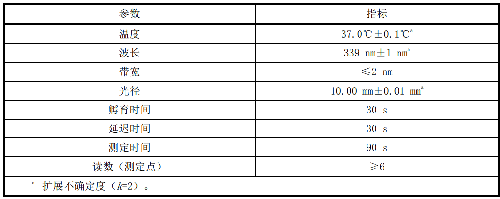
9.2.2 C.2.2 MD催化活性浓度测量条件,见表C.2。
表 C.2 MD 催化活性浓度测量条件
9.3 C.3 测量步骤
9.3.1 C.3.1 试剂准备
将一份适当体积(约0.400 mL)的起始试剂在37℃下平衡,为测定做准备。剩余的起始试剂必须保存在2℃~8℃。
9.3.2 C.3.2 测量程序
在比色杯中加入2.000 mL反应液,平衡到37℃。加入0.2000 mL按照C.1.2.3制备的MD溶液充分混匀,孵育30 s。孵育结束时,比色杯中溶液温度应达到37℃。再加入0.2000 mL起始试剂溶液,充分混匀,等待30 s后,再连续监测90 s的吸光度。
9.3.3 C.3.3 试剂空白
采用9 g·L-1(154 mmol·L-1)NaCl溶液代替被稀释的MD原液测定试剂空白,按上述方法进行操作。
9.4 C.4 计算
计算与AST催化浓度的计算相同,此结果是稀释后的最后溶液中的催化MD浓度。按式(C.1)计算储存酶溶液中LD催化活性浓度:
MDstock=F×Fdilution×∆A/∆tLD···················(C. 1)
式中:
MDstock——MD催化活性浓度,单位U/L除以1000可得kU·L-1;
F ——系数,等于 1905[在 339 nm 波长测定时,ε339(NADH)=630 ㎡·mol-1];
Fdilution——MD储存液的稀释因子,本例中为40401;
10 附录D(资料性附录)不同温度下溶液的pH值
D.1 不同温度下溶液 1 的 pH 值,见表 D.1。
表 D.1 不同温度下溶液 1 的 pH 值
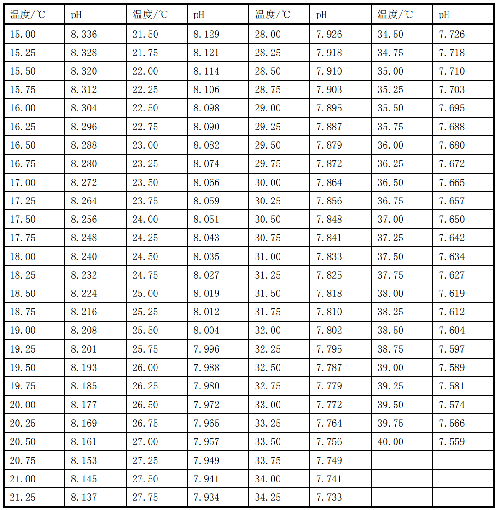
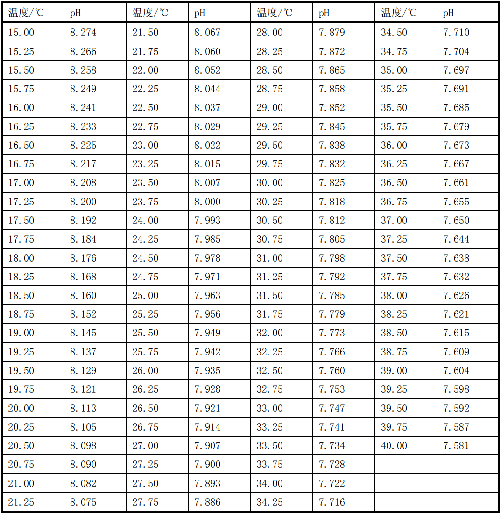
10.1 D.2 不同温度下溶液 2 的 pH,见表 D.2。
表 D.2 不同温度下溶液 2 的 pH 值
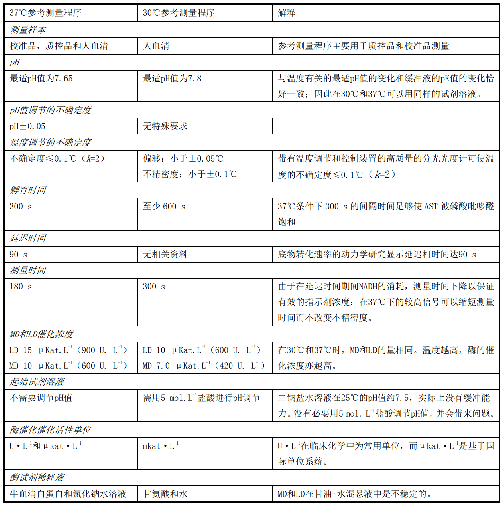
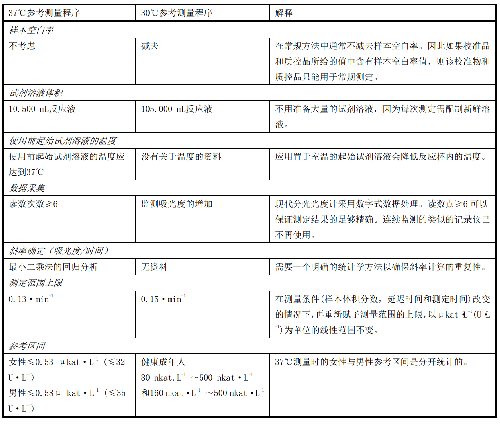
11 附录E(资料性附录)AST IFCC 37℃参考测量程序与 30℃参考测量程序的比较
E.1 目前的SOP源自IFCC参考测量程序,该参考测量程序为AST的催化活性浓度的测量提供了最佳条件。由37℃取代30℃作为测量温度,只需对某些测量参数进行微小改变即可保留最适的测量条件。
E.2 附录中列出了由37℃取代30℃作为测量温度时应对测量中的相关项做必要修改并必要时对其相关项进行解释,见表E.1。
表E.1 测量温度分别为37℃和30℃时的参考测量程序的比较
12 参考文献
[1]ISO 15193 : 2009 In vitro diagnostic medical devices – Measurement of quantities in samples of biological origin –Presentation of reference measurement procedures
[2]JCTLM;IFCC reference measurement procedure(37℃)for AST.2002
[3] BIPM/IEC/IFCC/ISO/IUPAC/IUPAP/OIML;Guide to the expression of uncertainty in measurement. GUM 2008.
[4] EURACHE/CITAC;Quantifing Uncertainty in Analytical Measurement. QUAM 2012